
下列有关元素的性质及其递变规律正确的是( )
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
科目:高中化学 来源: 题型:
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)(mol·L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 50 | 粉末状 |
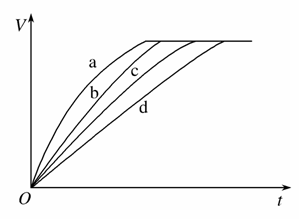
A.4-3-2-1 B.1-2-3-4
C.3-4-2-1 D.1-2-4-3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化或数据与氢键无关的是 ( )
A.水的沸点比硫化氢的沸点高
B.氨分子与水分子形成一水合氨
C.乙醇能跟水以任意比混溶
D.SbH3的沸点比PH3高
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜水溶液呈酸性,属保护性无机杀菌剂,对人畜比较安全,其与石灰乳混合可得“波尔多液”。实验室里需用480 mL 0.10 mol·L-1的硫酸铜溶液,则应选用的容量瓶规格和称取溶质的质量分别为 ( )
A.480 mL容量瓶,称取7.68 g硫酸铜
B.480 mL容量瓶,称取12.0 g胆矾
C.500 mL容量瓶,称取8.00 g硫酸铜
D.500 mL容量瓶,称取12.5 g胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1NaOH溶液450 mL和
0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 __0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度 0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
_______mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.任何情况下,温度都不可能对反应的方向起决定性作用
C.焓变与熵变是判断反应方向的两个主要因素
D.自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2A(g)+3B(g)4C(g)+D(g),已知起始浓度c(A)=4mol·L-1,c(B)=3mol·L-1,C、D浓度均等于0,反应开始2秒后达到平衡状态,此时D的平衡浓度为0.5mol·L-1,则下列说法不正确的是( )
A.反应速率v(C)=1mol·L-1·s-1
B.C的平衡浓度为4mol·L-1
C.A的转化率为25%
D.B的平衡浓度为1.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
保持相同温度时,可逆反应2A(g)+B(s)2C(g)在1×105 Pa达到平衡时的逆反应速率比在1×106 Pa达到平衡时的逆反应速率( )
A.大 B.小
C.相等 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.醋酸钠的水解反应CH3COO-+H3O+===CH3COOH+H2O
B.碳酸氢钙与少量的NaOH溶液反应Ca2++2HCO +2OH-===CaCO3↓+2H2O+CO
+2OH-===CaCO3↓+2H2O+CO
C.向AgCl悬浊液中滴加NaI溶液AgCl(s)+I-(aq)===AgI(s)+Cl-(aq)
D.稀硝酸与过量的铁屑反应Fe+4H++NO ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com