
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | |||
第一次 | 第二次 | 第三次 | ||
0.02 | 14 | 13 | 11 | |
0.002 | 6.7 | 6.6 | 6.7 | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
KMnO4酸性溶液 | H2C2O4溶液 | ||
浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
0.02 | 2 | b | 4 |
a | 2 | c | 4 |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
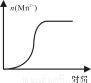
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。
(1)4;
(2)①2×10-4mol/(L·min)
②0.02 0.2或0.4 0.4或0.2
(3)①5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
②< 因为HC2O4-的电离程度大于HC2O4-的水解程度
(4)Mn2+对该反应有催化作用
【解析】
试题分析:(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,首先要在一定温度下,用一种浓度的KMnO4酸性溶液和H2C2O4进行实验作对照。然后通过改变KMnO4或H2C2O4的浓度来关系反应的快慢以测定浓度对反应速率的影响;再进行其它的条件不变,通过改变反应温度来测定反应速率,来实现温度对反应速率的影响;最后进行其它条件不变,加入催化剂来观察反应速率的快慢实现催化剂对反应速率的影响的实验。因此至少需要完成4组实验进行对比即可得出结论。(2)①用0.002 mol/L KMnO4酸性溶液进行实验时,Δt=(6.7+6.6+6.7)÷3=20/3min.v(KMnO4)=Δc÷Δt =0.002 mol/L×4÷(4+2) ÷20/3min=2×10-4mol/(L·min)。②若要得出“褪色时间越短,反应的速率越快”结论应该只改变一个量,其它都相同,观察褪色时间的长短。a=0.02;b=0.2,c=0.4或a=0.02;b=0.4,c=0.2.(3)①由电离平衡常数可知草酸是弱酸。因此根据氧化反应反应的规律及离子方程式的拆写原则可得:草酸与酸性高锰酸钾溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+= 2Mn2++ 10CO2↑+8H2O。②室温下,草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5可知草酸氢根离子的电离作用大于其水解作用,所以溶液呈酸性。pH<7.(4)n(Mn2+)在反应起始时变化不大,速率也变化不大,一段时间后由于n(Mn2+)增多,反应速率快速增大是因为Mn2+对该反应有催化作用。
考点:考查实验方案的设计、离子方程式的书写、多元弱酸的酸式盐的电离与水解及溶液的酸碱性的知识。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:2016届天津市五区县高一上学期期末考试化学试卷(解析版) 题型:选择题
下列气体中,可以用碱石灰干燥的是 ( )
A.CO2 B.Cl2 C.NH3 D.SO2
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一上学期期末质量检测化学试卷(解析版) 题型:选择题
与100mL0.1 mol·L—1AlCl3溶液中Cl—的物质的量浓度相等的是
A.50mL0.1 mol·L—1NaCl溶液 B.50mL0.15 mol·L—1MgCl2溶液
C.10mL1.0 mol·L—1FeCl3溶液 D.100mL0.3 mol·L—1 KClO3溶液
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2—>Z —
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。以下说法正确的是(温度均为25℃)
A.电离常数:K(HCN) <Ka2 (H2CO3)
B.浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN <NaHCO3
C.浓度均为0.1mol·L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等
D.pH均为10的 Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
下列反应中,同时符合图像Ⅰ和Ⅱ的是

A.N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.2SO3(g)  2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C.H2(g)+CO(g)  C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
D.4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法中不正确的是( )
A.减压分馏、常压分馏都是物理变化
B.乙酸乙酯和食用植物油均可水解生成乙醇
C.蔗糖、麦芽糖互为同分异构体
D.甘油、汽油都不属于油脂
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com