
【题目】甲烷的分子结构模型如图所示:

根据甲烷的分子结构模型,回答问题:
(1)甲烷的电子式是__,其含义是__。
(2)甲烷的结构式是__,其含义是_。
(3)甲烷分子的空间构型是__。
(4)更能真实反映甲烷分子结构模型的是__。
【答案】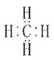 电子式可表示原子最外层电子成键情况
电子式可表示原子最外层电子成键情况  结构式除具有分子式表示的意义外,还能表示分子中原子的结合或排列顺序 正四面体结构 比例模型
结构式除具有分子式表示的意义外,还能表示分子中原子的结合或排列顺序 正四面体结构 比例模型
【解析】
本题考察了甲烷分子式、电子式、结构式表示的意义及其分子空间构型。电子式可表示原子最外层电子成键情况。结构式具有分子式所能表示的意义,能反映物质的结构,能表示分子中原子的结合或排列顺序,但不能表示其分子的空间构型。电子式可表示原子最外层电子成键情况。
(1)碳原子最外层有四个电子,和氢原子形成四对共用电子对,甲烷的电子式是 ,电子式可表示原子最外层电子成键情况;
,电子式可表示原子最外层电子成键情况;
故答案为: ;电子式可表示原子最外层电子成键情况;
;电子式可表示原子最外层电子成键情况;
(2)一对共用电子对表示一对共价键,所以甲烷的结构式是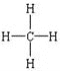 ,结构式具有分子式所能表示的意义,能反映物质的结构,能表示分子中原子的结合或排列顺序;
,结构式具有分子式所能表示的意义,能反映物质的结构,能表示分子中原子的结合或排列顺序;
故答案为: ;结构式除具有分子式表示的意义外,还能表示分子中原子的结合或排列顺序;
;结构式除具有分子式表示的意义外,还能表示分子中原子的结合或排列顺序;
(3)甲烷的价层电子对为四对,没有孤对电子,空间立体构型为正四面体形,甲烷分子为正四面体结构,碳原子位于正四面体中心,氢原子位于四个顶点上;
故答案为:正四面体结构;
(4)球棍模型和比例模型都能反映甲烷分子的空间构型,但比例模型更能形象的表达出氢原子、碳原子的位置及所占比例;
故答案为:比例模型。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是
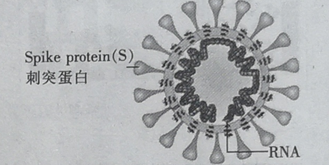
A.蛋白质和核酸均是高分子化合物
B.蛋白质中含C、H、O、N 等元素
C.五碳糖( C5H10O5)与葡萄糖互为同系物
D.NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以秸秆为原料制备某种聚酯高分子化合物的合成路线:
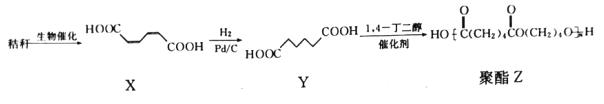
下列有关说法正确的是
A.X的化学式为C4H6O4
B.Y分子中有1个手性碳原子
C.生成聚酯Z的反应类型为加聚反应
D.制备聚酯Z,消耗Y和1,4-丁二醇的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是

A.图中阴影部分表示H2S分子的吸附与离解
B.AC表面作用的温度不同,H2S的去除率不同
C.H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D.图中反应过程中只有H—S键的断裂,没有H—S键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容的密闭容器中进行下列可逆反应:C(s)+H2O(g)![]() CO(g)+H2(g);现有下列状态:①混合气体的密度不再改变;②各气体的浓度相等;③反应体系中温度保持不变(假设为绝热容器);④相同时间内,断裂H—O键的速率是断裂H—H键速率的2倍;其中能表明反应达到平衡状态的是
CO(g)+H2(g);现有下列状态:①混合气体的密度不再改变;②各气体的浓度相等;③反应体系中温度保持不变(假设为绝热容器);④相同时间内,断裂H—O键的速率是断裂H—H键速率的2倍;其中能表明反应达到平衡状态的是
A.①②③B.②③C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
下列说法正确的是
A.ΔH1<0,ΔH2>0
B.反应①②③的反应热满足关系:ΔH1-ΔH2=ΔH3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取降温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的直接氧化法将HCl气体直接氧化成Cl2,方程式为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ/mol。400℃时,将4molHCl和4molO2(g)气体通入一容积固定为2L的密闭容器中,回答下列问题:
2Cl2(g)+2H2O(g) ΔH=-116kJ/mol。400℃时,将4molHCl和4molO2(g)气体通入一容积固定为2L的密闭容器中,回答下列问题:
(1)该反应的平衡常数表达式为___,K(300℃)___K(400℃)(填“<”,“=”或“>”)。
(2)若平衡时a(HCl)为80%,在相同条件下,密闭容器的体积缩小为1L,此反应达平衡时放出的热量(Q)可能是___(填字母序号)kJ。
A.0<Q<58 B.92.8<Q<116 C.371.2<Q<464 D.116<Q<232
(3)在一定条件下,体系中HCl的平衡转化率与L和X的关系如图所示,L和X分别表示温度或压强。

i.X表示的物理量是___。
ii.判断L1与L2的大小关系:L1___L2(填“<”,“=”或“>”)。
(4)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0,反应物HCl的转化率a(HCl)为___(请用P0、P来表示),有利于提高HCl平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
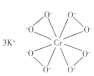
(1)基态Cr原子的未成对电子数为________________。
(2)![]() 的结构如图所示。
的结构如图所示。
①下列有关![]() 的说法正确的是__________(填标号)。
的说法正确的是__________(填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,![]() 。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
(3)雷氏盐的化学式为![]() 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________。
②其阳离子的中心原子的杂化方式为_________________,配体之一NH3分子的立体构型为______。
③与配体NCSˉ互为等电子体的阴离子有![]() 等,分子有_____________________(写1种);画出
等,分子有_____________________(写1种);画出![]() 的结构式:_____________________________。
的结构式:_____________________________。
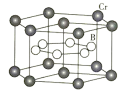
(4)![]() 的晶体密度为
的晶体密度为![]() ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为![]() ,高为
,高为![]() ,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com