
在一定条件下,反应N2+3H2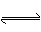 2NH3 在2 L密闭容器中进行,10 min时NH3的物质的量增加了0.2mol,则反应速率为
2NH3 在2 L密闭容器中进行,10 min时NH3的物质的量增加了0.2mol,则反应速率为
A.υ(H2)=0.02 mol / (L·min)
B.υ(N2)=0.02 mol / (L·min)
C.υ(NH3)=0.01 mol / (L·min)
D.υ(N2)=0.01 mol / (L·min)
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:2016届宁夏银川二中高三5月适应性训练理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.CH2=CH2与CH3CH2OH均可以使KMnO4(H+)褪色,且褪色原理相同
B.乙酸乙酯的制取中,水浴加热的目的有:加快化学反应速率,同时使产物分离,平衡正向移动
C.等物质量的CH3CH2OH与CH3COOH,均能与足量的金属钠发生取代反应,前者反应速率较后者慢,且生成等物质量的H2
D.在一溴乙烷中加入NaOH和CH3CH2OH,加热,加入HNO3酸化的AgNO3,出现淡黄色沉淀,说明溴乙烷发生了水解反应
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三高考前模拟理综化学试卷(解析版) 题型:实验题
实验室制备硝基苯的反应原理和实验装置如下:
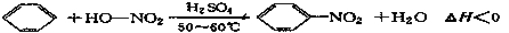
反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。
有关数据列如下表:
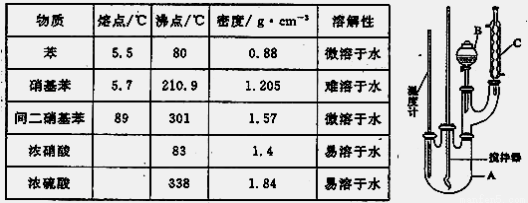
实验步骤如下:①取100mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混和酸,将混合酸小心加入B中;②把18 mL(15.84 g)苯加入A中;③向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束;④将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液、水洗涤并分液;⑤分出的产物加入无水CaCl2颗粒,静置片刻,然后倒入蒸馏烧瓶,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是____________________________。
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:_________________
___________ ____________________________________________________。
____________________________________________________。
(3)为了使反应在50℃~60℃下进行,常用的方法是________________________。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是_________。
(4)在洗涤操作中,第二次水洗的作用是_________________________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是___________________________________________________。
(6)本实验所得到的硝基苯产率是______________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市高三高考前最后一卷理综化学试卷(解析版) 题型:选择题
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z)原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是
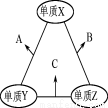
A.X元素位于ⅥA族
B.A不能溶于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:填空题
依据氧化还原反应:Zn+2FeCl3===ZnCl2+2FeCl2设计的原电池如图所示:
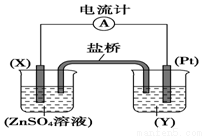
请回答下列问题:
(1)电极X的 材料是 ,电解质溶液Y是 。
材料是 ,电解质溶液Y是 。
(2)Pt电极为电池的________极,发生的电极 反应为_________ ;X电极上发生的电极反应为________。
(3)该装置中电子从 (填物质)极流出,盐桥中 (填阴、阳)离子向右边烧杯中溶液运动。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:选择题
已知X+Y=M+N为放热反应,则下列说法正确的是
A.断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放 出的能量
出的能量
B.X和Y的总能量一定高于M和N的总能量
C.Y的能量一定高于N
D.因为该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:填空题
CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义。利用CO2和CH4重整可制合成气(主要成分CO、H2).重整过程中部分反应的热化学方程式为:
①CH4(g)=C(s)+2H2(g) △H=+75.0 kJ/mol
②CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.0 kJ/mol
③CO(g)+H2(g)=C(s)+H2O(g) △H=-131.0kJ/mol
(1)反应CO2(g)+CH4(g)=2CO(g) + 2H2(g)的△H=____________;
(2)固定n(CO2)= n(CH4),改变反应温度,CO2和CH4的平衡转化率见下左图。
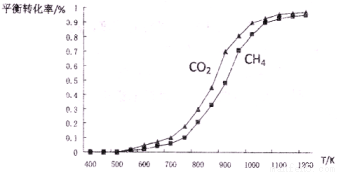
①同温度下CO2的平衡转化率____________(填“大于”或“小于”)CH4的平衡转化率,其原因是____________;
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是____________。
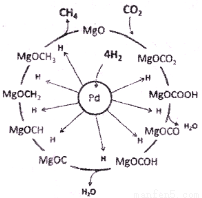
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如上右图所示,该反应的化学方程式为____________,反应过程中碳元素的化合价为-2价的中间体是____________。
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4 + Na2CO3=CaCO3 + Na2SO4,则达到平衡后,溶液中c(CO32-)/c(SO42-)=____________[用Ksp(CaSO4)和Ksp(CaCO3)表示]
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:选择题
下列说法正确的是
A.126C、136C、146C三种核素互为同素异形体
B. 和
和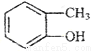 的分子式相同,化学性质也相同
的分子式相同,化学性质也相同
C.等质量的甲烷按a,b两种途径完全转化,途径a比途径b消耗更多的O2
途径a: ;途径b:
;途径b: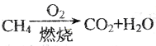
D.铝热反应实验说明:在一定条件下铝的还原性强于很多难熔金属
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三高考打靶测试理综化学试卷(解析版) 题型:填空题
【化学选修3:物质结构与性质】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒、硅等化学物质。
(1)基态铜原子的电子排布式为____________________;已知高温下CuO Cu2O+O2,从铜原子价电子层结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是_____________;
Cu2O+O2,从铜原子价电子层结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是_____________;
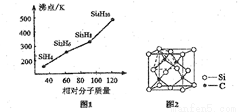
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为_______、_________,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应是单质硒是氧化剂,则硒与硅的电负性相对大小为Se_____Si(填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_______________;
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3,BF3.NH3中B原子的杂化轨道类型为__________,B与N之间形成________键;
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为__________,在SiC中,每个C原子周围最近的C原子数目为________,若晶胞的边长为a pm,则金刚砂的密度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com