
| A. | 相同温度下,AgCl的溶解性比Ag2CO3强 | |
| B. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| C. | 混合后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c(H+) | |
| D. | 混合后溶液中的:c(Na+)+c(H+)+c(Ag+)=2 c(CO32-)+c(HCO3-)+c(OH-) |
分析 A.氯化银和碳酸银阴阳离子之比不同,不能用溶度积常数比较溶解性;
B.2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq),平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{c}^{2}(C{l}^{-})}{c(C{{O}_{3}}^{2-})}$×$\frac{{c}^{2}(A{g}^{+})}{{c}^{2}(A{g}^{+})}$计算;
C.c(Cl-)=2×10-5mol/L,c (CO32-)=0.1mol/L;
D.据溶液中的电荷守恒分析.
解答 解:A.Ksp(Ag2CO3)=c(Ag+)2×0.1=1×10-11,c(Ag+)=10-5,Ksp(AgCl)=c(Cl-)×10-5=2×10-10,c(Cl-)=2×10-5mol/L,相同温度下,AgCl的溶解性比Ag2CO3强,故A正确;
B.2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq),平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{c}^{2}(C{l}^{-})}{c(C{{O}_{3}}^{2-})}$×$\frac{{c}^{2}(A{g}^{+})}{{c}^{2}(A{g}^{+})}$=$\frac{(Ksp(AgCl))^{2}}{ksp(A{g}_{2}C{O}_{3})}$=$\frac{(2×1{0}^{-10})^{2}}{1×1{0}^{-11}}$=4×10-9,故B错误;
C.c(Cl-)=2×10-5mol/L,c (CO32-)=0.1mol/L,所以c (CO32-)>c(Cl-),故C错误;
D.据电荷守恒,c(Na+)+c (H+)+c (Ag+)=2 c (CO32-)+c (HCO3-)+c (Cl-)+c (OH-),故D错误;
故选A.
点评 本题考查了沉淀的溶解平衡以及沉淀转化、溶度积的有关计算等,题目难度中等,注意把握溶度积的有关计算,侧重于考查学生的分析能力和计算能力.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| 元素 | 有关性质及结构信息 |
| X | 所有已知晶体中硬度最大 |
| Y | Y原子的最高价氧化物和气态氢化物能化合成一种盐 |
| Z | 其氢氧化物溶于强碱溶液但不溶于水 |
| W | 其单质常存在于火山喷口处 |
| A. | Y、Z形成的简单离子半径大小关系是Y<Z | |
| B. | H-W键与H-Y键键能较大的是H-W键 | |
| C. | XW2可清洗附着在试管内壁的硫 | |
| D. | Z2W3不能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Al3+、Na+、SO32-、HCO3- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
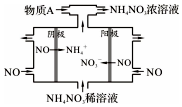 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮的固定是指气态氮变为固态 | |
| B. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| C. | 利用二氧化碳制造全降解塑料,可以缓解温室效应 | |
| D. | 石油分馏、煤的干馏、蛋白质的变性和纳米银粒子的聚集都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液与过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量的澄清石灰水与碳酸氢钠溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| C. | 硫酸与Ba(OH)2溶液反应:H++OH-=H2O | |
| D. | FeCl3溶液与Fe反应:Fe3++Fe=2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:乙>丙>丁>甲 | |
| B. | 简单气态氢化物的稳定性:甲>丁,这是因为甲的氢化物分子间存在氢键 | |
| C. | 甲和丁组成的化合物在熔融状态下可以导电 | |
| D. | 乙、丙、丁的最高价氧化物对应的水化物均能两两反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH减小 | B. | 溶液中所有离子的浓度减小 | ||
| C. | 氨水的电离程度变大 | D. | 氨水的电离平衡常数Kb不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl | B. | NH4HSO4 | C. | CH3COONH4 | D. | (NH4)2Fe(SO4)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com