
| A. | $\frac{5}{3}$X<P<$\frac{17}{9}$X | B. | P=X+$\frac{V•C}{12.5}$ | C. | Y=X+V•C | D. | C=$\frac{1000B}{11.2V}$ |
分析 根据题意利用反应过程中的变化进行分析计算,镁和铝的混合物中加入适量的稀硫酸全部反应生成氢气BL,和氯化镁和氯化铝;向反应后的溶液中加入Cmol/L氢氧化钾溶液V mL使金属离子刚好沉淀完全,得到的沉淀为氢氧化镁和氢氧化铝,质量为Yg,固体灼烧得到氧化镁和氧化铝质量为Pg,结合各步反应进行计算判断.
解答 解:反应化学方程式为Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑、MgSO4+2KOH=Mg(OH)2↓+K2SO4、Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4、Mg(OH)2$\frac{\underline{\;加热\;}}{\;}$MgO+H2O、2Al(OH)3$\frac{\underline{\;加热\;}}{\;}$Al2O3+3H2O,
A.氧化镁和氧化铝的质量可以按照极值方法计算,若Xg全是镁,得到的氧化物为氧化镁,根据元素守恒,则质量为P=$\frac{X}{24}×40$=$\frac{5}{3}$Y,若Xg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为P=$\frac{X}{27}×102×\frac{1}{2}$=$\frac{17}{9}$Y,质量介于二者之间,故A正确;
B.P为生成的氧化物的质量,1molMg可结合1molO,2molAl结合3mol O,因此生成沉淀的物质的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半,即P=$\frac{CV×1{0}^{-3}}{2}$×16+X=X+$\frac{CV}{125}$,故B正确;
C.得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,即Y=X+$\frac{CV}{1000}$×17,故C错误;
D.根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,即B=22.4L/mol×$\frac{CV×1{0}^{-3}}{2}$,整理得C=$\frac{1000B}{11.2V}$,故D正确;
故选C.
点评 本题考查混合物的计算,侧重于物质的量应用于化学方程式的计算的考查,题目信息量较大,题目难度中等,易错点为A,注意利用极值方法计算,试题培养了学生的化学计算能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:多选题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应,转移的电子数一定为0.2NA | |
| B. | 标准状况下,22.4L SO3中含有氧原子数为3 NA | |
| C. | 标准状况下,18g H2O中含有氧原子数为NA | |
| D. | 5.4g 铝单质与足量NaOH溶液反应,转移电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Cu2+、NO3- | B. | Na+、Al3+、OH-、Cl- | ||
| C. | Ag+、K+、Cl-、OH- | D. | Na+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ba2+、HCO3-、NH4+、NO3- | ||
| C. | K+、Cu2+、Cl-、OH- | D. | Na+、CO32-、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
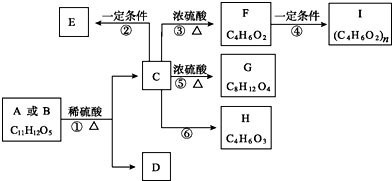
 .
.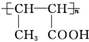 b.D在一定条件下也可以反应形成高聚物
b.D在一定条件下也可以反应形成高聚物 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HC1为强电解质,可推测HF也为强电解质 | |
| B. | NH4+为正四面体结构,可推测PH4+也为正四面体结构 | |
| C. | C02晶体是分子晶体,可推测Si02晶体也是分子晶体 | |
| D. | C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥⑧ | B. | ①②③④⑤⑧ | C. | ②③④⑤⑧ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、O2混合气体和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | NO2和H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com