
【题目】下列有关说法正确的是
A.把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色
B.自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性
C.Cl2、Cl-均有毒
D.Cl2、HClO、H2O2都具有漂白性
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2mol Y气体,发生如下反应:X(g) + 2Y(g)![]() 2Z(g) △H<0,平衡时生成1.5mol Z。下列说法不正确的是
2Z(g) △H<0,平衡时生成1.5mol Z。下列说法不正确的是
A.增大压强或降低温度,平衡常数K都增大
B.其它条件相同,向容器中只加入2molZ,能建立完全相同的平衡状态
C.平衡时,平衡常数K=36a (mol/L)-1
D.某时刻X、Y、Z物质的量分别是0.3mol,1mol和1.1mol,反应正向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
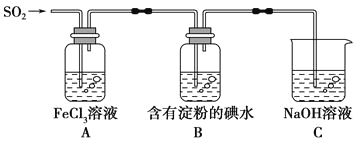
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液退色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色退去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是______________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为____________,中心原子的杂化方式为____________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO____________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
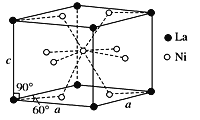
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是____________cm3(用含M、d、NA的代数式表示)。
[化学—选修5:有机化学基础]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列叙述正确的是( )
A.鲜榨橙汁遇到碘水会变蓝 B.馒头越嚼越甜
C.油脂经水解可变成葡萄糖 D.土豆中的淀粉经水解可变成酒(乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR。则在此反应中Y和M的质量之比为
A.16:9 B.23:9 C.32:9 D. 46:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定体积一定浓度的NaOH溶液时,下列操作导致结果偏高的是
A.称量NaOH固体时动作缓慢 B.定容时俯视刻度线
C.定容后振荡发现液面低于刻度线 D.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 工业上可利用CO生产乙醇:
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=___________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有___ 。
CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有___ 。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
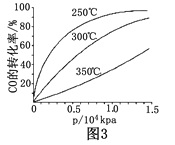
CO(g)+ 2H2(g)![]() CH3OH(g)在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
CH3OH(g)在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为 (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_________L。
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图. 当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、 1.3×104 kPa左右,选择此压强的理由是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com