
分析 (1)已知:①CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1,
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1,
根据盖斯定律①×2+②可得;
(2)钢铁发生吸氧腐蚀,负极上Fe失电子发生氧化反应,正极上氧气得电子发生还原反应.
解答 解:(1)已知:①CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1,
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1,
根据盖斯定律①×2+②可得:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-46kJ•mol-1;
故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-46kJ•mol-1;
(2)钢铁发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,负极上Fe失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,
故答案为:正极:O2+2H2O+4e-=4OH-;负极:Fe-2e-=Fe2+.
点评 本题考查了盖斯定律和金属的吸氧腐蚀,题目较简单,有利于学生巩固基础.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2和CO对容器产生的压强之比是7:11 | |
| B. | CO2和CO的密度之比是11:7 | |
| C. | CO2和CO的分子数相等 | |
| D. | CO2和CO的氧原子个数比是22:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有12 mol KI 被氧化 | B. | 转移11 mol电子 | ||
| C. | 生成CuI 382g | D. | I2只是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| C. | 钢铁在潮湿的空气中容易生锈 | |
| D. | 加入催化剂有利于氨催化氧化的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
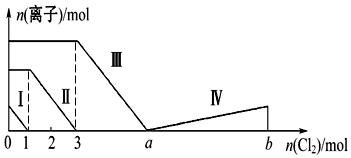
| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeBr2):n(FeI2)=1:3 | ||
| C. | 线段Ⅳ表示IO3-的变化情况 | D. | 根据图象无法计算a的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室要配制0.lmol/LNaOH溶液400mL,需称取NaOH 固体1.6g | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | Al2O3熔点很高,可用作耐火材料 | |
| D. | 纯锌和铁相连接后,插入同一稀盐酸中,锌极上发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{z}{12m}$ | B. | $\frac{12z}{m}$ | C. | $\frac{{N}_{A}}{m}$ | D. | $\frac{{N}_{A}}{z}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com