
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2D | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
 ,该氧化物的化学式为
,该氧化物的化学式为| m |
| V |
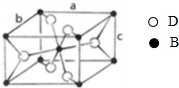
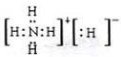 ,
,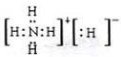 ;离子;
;离子; 可知,晶胞中Ti原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Ti元素数目=1+8×
可知,晶胞中Ti原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Ti元素数目=1+8×| 1 |
| 8 |
| 1 |
| 2 |
| 80 |
| NA |
2×
| ||
| 6.348×10-23cm 3 |
| 160 |
| 6.348×10-23N A |
| 160 |
| 6.348×10-23N A |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| B、同一原子中,2p,3p,4p能级的轨道依次增多 |
| C、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| D、CH2O和ClO4-的中心原子上都含有孤对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
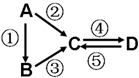 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4O与C2H6O一定互为同系物 |
| B、1mol C6H6(苯)中含有3mol碳碳双键 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、向乙酸乙酯中加入NaOH 溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
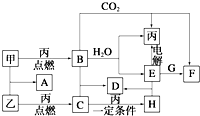 甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:
甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
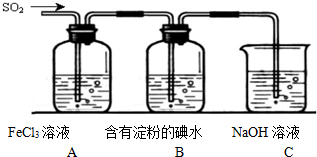
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com