
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca (OH)2投入过量NaHCO3溶液中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
D
【解析】
试题分析:①金属钠投入到FeC12溶液中,钠与水反应生成氢氧化钠,氢氧化钠与氯化亚铁反应生成白色沉淀氢氧化亚铁,但最终氢氧化亚铁转化为红褐色氢氧化铁沉淀,错误;②过量NaOH溶液和明矾溶液混合,过量的氢氧化钠与明矾中的铝离子反应生成偏铝酸根离子,无白色沉淀生成,错误;[来源:学③少量Ca (OH)2投入过量NaHCO3溶液中,生成白色的碳酸钙沉淀,正确;④向NaAlO2溶液中通入过量CO2,生成的氢氧化铝沉淀,不溶于碳酸,所以有白色沉淀生成,正确;⑤向饱和Na2CO3溶液中通入过量CO2,生成碳酸氢钠,因为碳酸氢钠的溶解度小于碳酸钠,所以有白色沉淀生成,正确,答案选D。
考点:考查物质反应的现象的判断


科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
现有等物质的量组成的Fe、Cu合金共0.1 mol,研成粉末后,全部投入稀硝酸中,微热使其充分反应,已知硝酸的还原产物只有NO。由于HNO3用量的不同,溶液中的金属离子和残留固体的成分会有多种情况。下列说法正确的是
A.根据溶液中的金属离子和残留固体的成分最多会有5种情况
B.若金属有剩余,在溶液中再滴入稀硫酸后,金属不会溶解
C.当合金刚好溶解时,在标准状况下产生2.24LNO
D.若合金全部溶解,在溶液中加入过量的氨水,(已知铜离子可转化为四氨合铜络离子溶于水)则经过滤、洗涤、干燥、充分灼烧、称量可得固体4g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
化学在人类生活中扮演着重要角色,以下应用正确的是
A.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
B.日常生活中无水乙醇常用于杀菌消毒
C.使用无磷洗衣粉,可彻底解决水体富营养化问题
D.天然药物无任何毒副作用,可长期服用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(13分)对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) 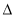 H= +180.5kJ·mol-1;
H= +180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) 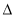 H = -483.6 kJ·mol-1;
H = -483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) 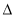 H = -92.4 kJ·mol-1。
H = -92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g) 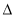 H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。

①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。

(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02×1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列图示与对应的叙述不相符的是

A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
②NH3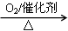 NO
NO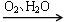 HNO3
HNO3
③NaCl(饱和)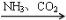 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2 SO3
SO3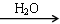 H2SO4
H2SO4
A.②③ B.①④ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
(11分)应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) △H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H = -566.0 kJ/mol
H2O(g)=H2O(1) △H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H= + 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
(3)已知A和B在一定条件下可建立如下平衡:2A(g)+B(g) 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
①达到平衡所需时间是Ⅰ Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是Ⅰ Ⅱ。
②平衡时,测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列关于C、Si、S、Cl四种非金属元素的说法中,正确的是
A.在自然界中都能以游离态存在
B.两两结合形成的化合物都是共价化合物
C.氢化物的热稳定性比较:CH4 < SiH4 < H2S < HCl
D.最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
实验室需480 mL 1.0 mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是:
A.称取氢氧化钠20.0 g
B.定容时俯视观察刻度线
C.移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗
D.移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com