
����Ŀ�����������仯���������������������Ź㷺��Ӧ�ã�
��1����ҵ��ұ�����Ļ�ѧ����ʽ�� ��
��2���ҹ��״��ĺ�����������Ϊ����������Ϊ��������ˮΪ�������Һ�������е�����������Ӧ��������������ܷ�ӦΪ4Al+3O2+6H2O�T4Al��OH��3 �� ����ӦʽΪ ��
��3��ij�о���ѧϰС���������ͼ1��ʾװ��̽�������ĸ�ʴ������� 
����ͬ�����£�����װ�������缫��ʴ������������ţ���Ϊ��ֹ����Fe����ʴ�����Բ�������������ţ�װ��ԭ�����з�����
��4����ͼ2��ʾ�������5minʱC����������������2.16g���ݴ˻ش���õ�Դ�缫Y����Ϊ �� �������ߵĵ������ʵ����� �� A����̼���ϵĵ缫��Ӧʽ�� �� B���д�ͭ�缫�ϴ��ڵĵ缫��Ӧʽ�� �� C����һ��ʱ�����������ҺŨ����������С�䣩��
���𰸡�
��1��2Al2O3 ![]() 4Al+3O2��
4Al+3O2��
��2��Al��3e��=Al3+
��3���٣��ڢ�
��4��������0.02mol��2Cl����2e��=Cl2���� Cu��2e��=Cu2+������
���������⣺��1����ҵ��ұ�����Ļ�ѧ����ʽ�ǣ�2Al2O3 ![]() 4Al+3O2����
4Al+3O2����
���Դ��ǣ�2Al2O3 ![]() 4Al+3O2������2���ҹ��״��ĺ�����������Ϊ����������Ϊ��������ˮΪ�������Һ�������е�����������Ӧ��������������ܷ�ӦΪ4Al+3O2+6H2O�T4Al��OH��3����������ʧ���ӱ�����������ӦʽΪ��Al��3e��=Al3+��
4Al+3O2������2���ҹ��״��ĺ�����������Ϊ����������Ϊ��������ˮΪ�������Һ�������е�����������Ӧ��������������ܷ�ӦΪ4Al+3O2+6H2O�T4Al��OH��3����������ʧ���ӱ�����������ӦʽΪ��Al��3e��=Al3+��
���Դ��ǣ�Al��3e��=Al3+����3����װ��Ϊԭ�����Ϊ��������ʴ����װ��Ϊԭ���п����������ʴ��������������������װ��Ϊ���أ���������������������װ�������缫��ʴ��죬������Ӧ�������õ����ӷ�����ԭ��Ӧ���缫��ӦΪ��O2+2H2O+4e��=4OH�������и����Ͻ���пʧ���ӣ��缫��ӦΪ��Zn��2e��=Zn2+������������������ʱ���������Բ�����������������������װ�â��з������ǵ�ⱥ��ʳ��ˮ�ķ�Ӧ��������������ʧ�������������������������ӵõ����ӷ�����ԭ��Ӧ����������������
���Դ��ǣ��٣��ڢۣ���4����ͼ2��ʾ�������5minʱC����������������2.16g����C������Ϊ�������缫��ӦΪ��Ag++e��=Ag�����������Ϊ�����������������ʵ���= ![]() =0.02mol������ת�������ʵ���Ϊ0.02mol��Ag�缫Ϊ�������缫��ӦΪ��Ag��e��=Ag+��C��Ϊ��Ƴص������Һ������Ũ�Ȳ��䣬�����жϣ�Bװ�������δ�ͭ���������缫��ӦΪCu2++2e��=Cu����ͭ���������缫��ӦΪCu��2e��=Cu2+��Aװ�����������������缫��ӦΪ��2H++2e��=H2����̼�����������缫��ӦΪ��2Cl����2e��=Cl2����XΪ������YΪ������
=0.02mol������ת�������ʵ���Ϊ0.02mol��Ag�缫Ϊ�������缫��ӦΪ��Ag��e��=Ag+��C��Ϊ��Ƴص������Һ������Ũ�Ȳ��䣬�����жϣ�Bװ�������δ�ͭ���������缫��ӦΪCu2++2e��=Cu����ͭ���������缫��ӦΪCu��2e��=Cu2+��Aװ�����������������缫��ӦΪ��2H++2e��=H2����̼�����������缫��ӦΪ��2Cl����2e��=Cl2����XΪ������YΪ������
���Դ��ǣ������� 0.02mol�� 2Cl����2e��=Cl2����Cu��2e��=Cu2+�����䣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ��ѧ����������Ƶ�ʾ��ͼ����ʾ������˵������ȷ����

ѡ�� | ������ | ������ | �о����� |
A | ��Ӧ���� | ���� | NH4Cl��Ba(OH)2 ��8H2O��Ӧ |
B | ��Ӧ�¶� | ��Ӧ���� | ø����Ӧ |
C | HCl��Һ��� | �������� | 0.1 mol��L��1����μӵ�ͬŨ��AgNO3��Һ�� |
D | ��Ӧʱ�� | ��Һ�¶� | ����δ��ĥ��þ������1mol��L��1H2SO4��Һ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���OH-��CO32-��A1O2-��SiO32-��SO42-��HCO3-��Na+��Fe3+��Mg2+��Al3+�����ӡ��������Һ����μ���һ�����ʵ���Ũ�ȵ�������Һʱ���������ɳ��������ʵ�����������Һ������仯����ͼ��ʾ������˵����ȷ����
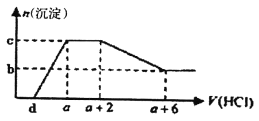
A. ԭ��Һ�п��ܺ���Na2SO4�����ܲ�����CO32-
B. ԭ��Һ��һ�����е�������ֻ��:OH-��A1O2-��CO32-
C. ԭ��Һ�к�CO32-��A1O2-�����ʵ���֮��Ϊ3:4
D. a-d>3/4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CH3CHO+NaOH+2Cu(OH)2![]() CH3COONa+Cu2O��+3H2O����ȩ�ࡣ
CH3COONa+Cu2O��+3H2O����ȩ�ࡣ
��1����̬Cu2+��������Ų�ʽΪ_________��
��2��CH3COONa��̼ԭ�ӹ�����ӻ�������______��1 mol CH3COONa�к��ЦҼ�����ĿΪ_______��
��3����OH�� ���ӻ�Ϊ�ȵ������������Ϊ________��
��4���е�ߵͣ������ƣ������ȩ��������Ϊ_________��
��5��Cu2O ����ṹ������________������ĸ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ϩ���뱽��һ�������·�Ӧ���ɷ��������磺![]() +H2C�TCH2
+H2C�TCH2 ![]()
![]()
![]() +2H2C�TCH2
+2H2C�TCH2 ![]()
![]()
![]() +2H2C�TCH2
+2H2C�TCH2 ![]()
![]()
��ϩ������ϳɲ��ϵĻ���ԭ�ϣ������ںϳ�Ӧ�ù㷺��DAP��֬�����˫�ӵ��л��������Ҫ�Ĺ�ҵ��;��
��1��д����ϩ��һ�������·����ۺϷ�Ӧ�Ļ�ѧ����ʽ ��
��2����ϩ��������������O2��Ӧ�����л���A���������ܶ�����ͬ״���¼����ܶȵ�6.25����Ԫ�ص���������Ϊ��̼60%����32%��A�ķ���ʽΪ ��
��3����ϩ�뱽��һ�������·�Ӧ������M��N�ȶ��ַ�������������ס��˴Ź������о��л���ṹ����Ҫ�����������������ݣ�д��M��N�Ľṹ��ʽ��
M��Ԫ����ɣ�C 89.99%��H 10.06%��1H�˴Ź�����5���źţ�
N��Ԫ����ɣ�C 88.82%��H 11.18%��1H�˴Ź�����3���źţ�
M�� �� N�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�ͬ��������о�����C��H��O����Ԫ�ص��ǣ�������
A.��
B.����
C.����
D.��֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ϊ��Ԫ���
H2C2O4![]() HC2O4��+H+ Ka1
HC2O4��+H+ Ka1
HC2O4��![]() C2O42��+H+ Ka2
C2O42��+H+ Ka2
����������ijŨ�ȵIJ�����Һ����μ���һ����Ũ�ȵ�KOH��Һ��������Һ��H2C2O4��HC2O4����C2O42�������������ʵ�����������������ҺpH�Ĺ�ϵ��ͼ��ʾ��������˵��������ȷ����

A��pH=1.2��Һ����c(K+) + c(H+) = c(OH��) + c(H2C2O4)
B��pH=2.7��Һ����c2(HC2O4��) / [c(H2C2O4) �� c(C2O42��)]=1000
C������ͬ���ʵ���KHC2O4��K2C2O4������ȫ����ˮ�����pHΪ4.2�Ļ��Һ
D����pH=1.2����Һ�м�KOH��Һ��pH������4.2�Ĺ�����ˮ�ĵ����һֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ⱦջ���ʱ����������ϲ�����ϼ��ű�����������������Ρ�ֹ�Ȼ�̵�ȹ�Ч����������Ҫ�ɷ����� ��
A�������� B������ C����ѿ�� D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���׳ơ�һ���㡱���ж����ʱ���ʳ�ú�����˸����������°�����һ���㡱�ķ��ӽṹ��ͼ��ʾ������˵����ȷ����

A. ���л������ʽΪ��C7H10O3
B. ���л����������ӿ�����ͬ��ƽ��
C. ���л����ܷ���ȡ�����ӳɡ���������ԭ��Ӧ
D. ���л����һ�ֺ�������ͬ���칹���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com