
| A. | 硫酸钡难溶于水,其水溶液导电能力极弱,所以硫酸钡不是电解质 | |
| B. | CO2溶于水得到的溶液能导电,所以CO2是电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他物质都是非电解质 | |
| D. | 电解质与非电解质的本质区别是在水溶液或熔化状态下能否电离 |
分析 电解质在水溶液或熔融状态下,且存在自由移动的离子时才能导电,溶液的导电能力取决于离子浓度大小,强电解质的导电能力不一定强,以此解答该题.
解答 解:A.BaSO4不溶于水,其水溶液的导电能力很弱,是由于溶液中离子浓度较小的缘故,但硫酸钡为强电解质,故A错误;B.二氧化碳不能电离,其水溶液能导电,是由于二氧化碳与水反应生成的碳酸导电,故二氧化碳是非电解质,故B错误;C.多数的金属氧化物熔融状态也能导电,属于电解质,故C错误;D.在水溶液中或熔化状态下能导电的化合物是电解质,不能导电就是非电解质,故D正确,故选D.
点评 本题主要考查电解质的概念、导电能力与离子浓度的关系,注意电解质和非电解质都必须是化合物,溶液的导电能力与溶液中的离子浓度有关,与电解质的强弱无关,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
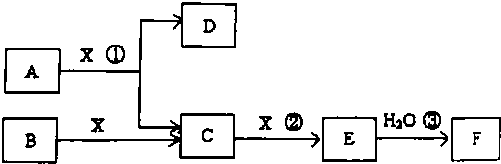
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g溶液中含有0.9g NaCl | B. | 100g水中含有0.9g NaCl | ||
| C. | 100g溶液中含有0.9mol NaCl | D. | 100g水中含有0.9mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| B. | 将饱和FeCl3溶液逐滴加入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | Al(OH)3胶体能使水中的悬浮颗粒沉降,达到净水的目的 | |
| D. | 豆浆、蔗糖溶液均属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
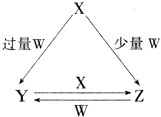 X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量镁粉的Fe2(SO)3溶液 | |
| B. | FeCl2溶液与稀硝酸混合后的溶液 | |
| C. | 铁丝在足量的氯气中燃烧后所得产物的溶液 | |
| D. | 长期暴露在空气中的绿矾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com