
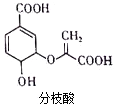
| A. | 分子中含有2种官能团 | |
| B. | 一定条件下,能与乙醇或乙酸发生相同类型的反应 | |
| C. | 1mol分枝酸最多可与3molNaOH发生反应 | |
| D. | 可运用同一原理分别使溴的四氯化碳溶液与酸性高锰酸钾溶液褪色 |
分析 由结构可知,分子中含-COOH、-OH、醚键、碳碳双键,结合羧酸、醇、烯烃等有机物的性质来解答.
解答 解:A.含-COOH、-OH、醚键、碳碳双键,共4种官能团,故A错误;
B.含-OH与乙酸发生酯化反应,含-COOH与乙醇发生酯化反应,故B正确;
C.只有2个-COOH与NaOH反应,则1mol分枝酸最多可与2molNaOH发生反应,故C错误;
D.含碳碳双键,与溴的四氯化碳溶液发生加成反应,与酸性高锰酸钾溶液发生氧化反应,均褪色,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀淀溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 检验氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 →
→ 下列说法不正确的是( )
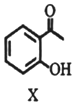
下列说法不正确的是( )| A. | 物质X的分子式为C8H8O2 | |
| B. | 物质X中所有碳原子可能在同一平面内 | |
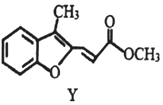
| C. | 物质Y的1H核磁共振谱图中有8组特征峰 | |
| D. | 1molY最多可与6mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用漂白液漂洗衣物:H2O+2NaClO+CO2═2HClO+CO32-+2Na+ | |
| B. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4(S)+CO32-(aq)?CaCO3(S)+SO42-(aq) | |
| C. | 用氢氧化钠溶液处理工业含二氧化硫的尾气:SO2+2OH-═HSO3-+H2O | |
| D. | 用加少量铁粉的方法存放硫酸亚铁溶液:Fe3++Fe═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 步骤 | 现象 |
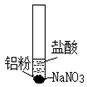 | ⅰ.取少量铝粉于试管,并加入盐酸 | 初始未见明显现象,一段时间后,冒出无色气泡. |
| ⅱ.在试管加入硝酸钠固体 | 继续冒出气泡,液面上方呈浅棕色,试管逐渐变热至沸腾. | |
| ⅲ.用湿润KI-淀粉试纸靠近试管口 | KI-淀粉试纸变蓝色. |
| 装置 | 步骤 | 现象 |
 | ⅰ.取少量铝粉于试管,并加入氢氧化钠溶液 | 初始未见明显现象,一段时间后,冒无色气泡. |
| ⅱ.向试管中加入硝酸钠固体 | 继续冒出无色气泡,并有刺激性气味产生 | |
| ⅲ.用湿润红色石蕊试纸靠近试管口 | 试纸变蓝 | |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+具有氧化性,可用KSCN溶液鉴别Fe3+ | |
| B. | H+、Na+、Fe2+、MnO4-在水溶液中不能大量共存 | |
| C. | 磁性氧化铁溶于稀硝酸的离子方程式:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | 将水蒸气通过灼热的铁粉,粉末变红,说明铁与水蒸气在高温下发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 7.8g过氧化钠与足量水反应,转移电子数为0.2NA | |
| C. | 常温常压下,6gO2和26gO3混合气体中的原子总数为2NA | |
| D. | 100mL0.1mol/L的Na2SO4溶液中,所含离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 达平衡时,6v(H2)正=2 v(CO2)逆 | B. | 正反应的反应热:△H<0 | ||
| C. | 平衡常数:Kb<Kc | D. | 曲线I的投料:n(H2):n(CO2)=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com