
| A. | 在稀硫酸中加人铜粉,铜粉不溶解;再加人NaNO3固体,铜粉仍不溶解 | |
| B. | 向明矾溶液中加人过量NaOH溶液会产生大量白色沉淀 | |
| C. | 除去FeCl3中少量的FeCl2,加人过量稀硝睃 | |
| D. | 浓硫酸、浓硝酸在加热条件下能将木炭氧化为二氧化碳 |
分析 A、金属铜可以和硝酸发生化学反应,而和硫酸不反应;
B、氢氧化铝会溶于过量的强碱中;
C、除杂不能引入新杂质;
D、木炭在加热条件下能被浓硫酸浓硝酸氧化为二氧化碳
解答 解:A、金属铜可以和硝酸发生化学反应,而和硫酸不反应,稀硫酸中加人NaNO3固体相当于溶液中存在硝酸,所以金属铜会溶解,故A错误;
B、明矾溶液中加人过量NaOH溶液,铝离子生成的沉淀会溶解在氢氧化钠溶液中,无沉淀生成,故B错误;
C、除去FeCl3中少量的FeCl2,加人过量稀硝酸,引入硝酸根离子和氢离子,为不引入杂质可通入氯气,故C错误;
D、浓硫酸、浓硝酸都具有强氧化性,加热条件下都能将木炭氧化为二氧化碳,故D正确;
故选D.
点评 本题考查了明矾、氯气、浓硫酸、浓硝酸等物质的性质应用,关键是氢氧化铝的两性,铁与水反应的产物判断.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
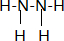
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.10 | B. | 0.20 | C. | 0.30 | D. | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
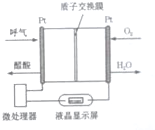
| A. | 电流由O2所在的铂电极流出 | |
| B. | O2所在的铂电极处发生还原反应 | |
| C. | 该电池的负极反应式为CH3CH2OH+3H2O-12e-=2CO2↑+12H+ | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
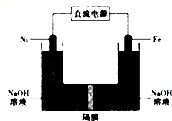 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰箱中使用的含氟制冷剂泄露后,会增加空气中的PM2.5 | |
| B. | 节日焰火的五彩缤纷是某些金属单质性质的体现 | |
| C. | 施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用 | |
| D. | 化学反应能够制造出新的物质,同时也能制造出新的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
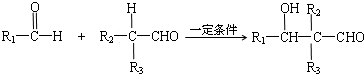
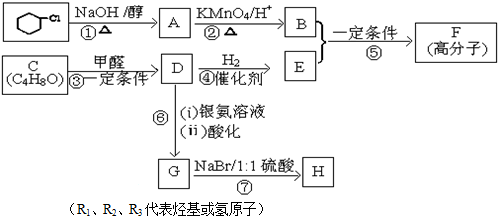
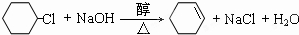 .
.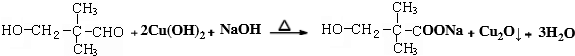
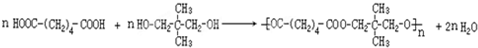 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com