
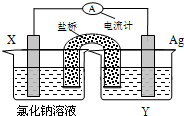
 依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计的原电池如图所示.
依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计的原电池如图所示.

科目:高中化学 来源: 题型:
 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据所学化学反应原理,解决以下问题:
根据所学化学反应原理,解决以下问题:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
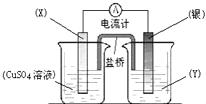 依据氧化还原反应:2Ag+(aq)+Cu(s)?Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列说法不正确的是( )
依据氧化还原反应:2Ag+(aq)+Cu(s)?Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列说法不正确的是( )| A、电极X的材料是铜 | B、电解质溶液Y是硝酸银溶液 | C、银电极为电池的正极,发生的电极反应为:Ag++e-?Ag | D、盐桥中的阳离子向硫酸铜溶液中运动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com