
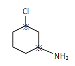
【题目】磷酸氯喹是一种广谱抗疟疾和抗炎药,临床试验证明:该药物在细胞水平上能有效抑制新型冠状病毒的感染。磷酸氯喹可由氯喹(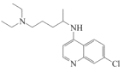 )和磷酸在一定条件下制得。氯喹的合成路线如图:
)和磷酸在一定条件下制得。氯喹的合成路线如图:
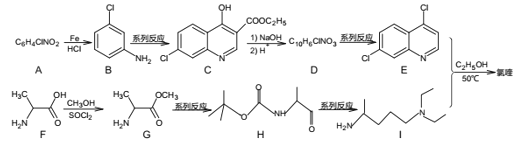
已知:①A为芳香族化合物;②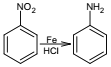 ;③
;③![]() 具有酸性。
具有酸性。
回答下列问题:
(1)A的结构简式为__,F的名称为__,H中的含氧官能团名称为__。
(2)A→B、F→G的反应类型分别为__。
(3)写出C与NaOH反应的化学方程式__。
(4)碳原子上连接有4个不同的原子或原子团时,该碳原子称为手性碳。B与足量H2加成后的产物为X,写出X的结构简式,并用※标识手性碳__。
(5)Y是G的同系物,分子式为C5H11NO2,其同时含有氨基和羧基的同分异构体有__种,其中核磁共振氢谱有4组峰,峰面积之比为6:2:2:1的结构简式为__。
【答案】 2-氨基丙酸 酯基和醛基 还原反应、取代反应
2-氨基丙酸 酯基和醛基 还原反应、取代反应 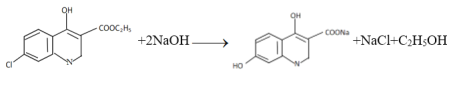
 12
12 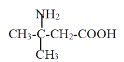
【解析】
A在Fe/HCl条件下生成B,根据已知②可知,A中含有-NO2;通过C、D的分子式比较和反应条件可知,C发生酯基的水解反应生成D。F生成G为醇羟基间的脱水反应。
(1)根据已知②可知,A中含有-NO2,再根据A的分子式和B的结构可知,A的结构简式为 ;根据系统命名法,F的名称为2-氨基丙酸;根据H的结构简式可知,H中的含氧官能团名称为酯基和醛基。
;根据系统命名法,F的名称为2-氨基丙酸;根据H的结构简式可知,H中的含氧官能团名称为酯基和醛基。
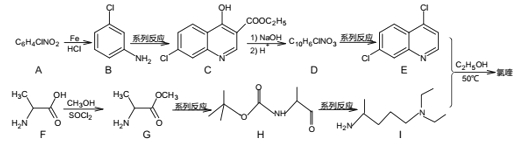
(2)A→B发生脱氧加氢反应,反应类型为还原反应;F→G发生的是醇羟基间的脱水反应,反应类型取代反应。
(3)C与NaOH反应,即官能团酯基、-Cl发生反应,化学方程式为 。
。
(4)碳原子上连接有4个不同的原子或原子团时,该碳原子称为手性碳。B与足量H2加成后的产物为X,X的结构简式为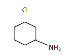 ,分子中无对称轴根据已知标识手性碳为
,分子中无对称轴根据已知标识手性碳为 。
。
(5)Y是G的同系物,则Y结构中含有一个酯基和一个氨基,分子式为C5H11NO2,同时含有氨基和羧基的同分异构体碳骨架有C-C-C-C-COOH、![]() 、
、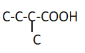
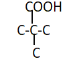 ,对应氨基的位置分别有4种、3种、4种、1种,故满足条件的同分异构体共有12种,其中核磁共振氢谱有4组峰,峰面积之比为6:2:2:1的结构简式为
,对应氨基的位置分别有4种、3种、4种、1种,故满足条件的同分异构体共有12种,其中核磁共振氢谱有4组峰,峰面积之比为6:2:2:1的结构简式为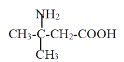 。
。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]·3H2O)易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:
Fe +H2SO4 = FeSO4 +H2↑
FeSO4 + H2C2O4 + 2H2O =FeC2O4·2H2O↓+ H2SO4
2FeC2O4·2H2O + H2O2 + H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
回答下列问题:
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是________(选填序号);
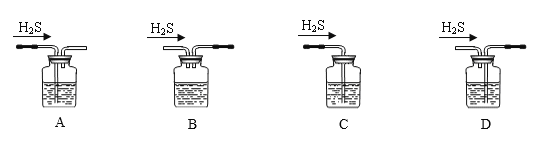
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40℃,理由是________;
(3)得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入_____溶剂(填编号)
a. 冰水 b. 无水乙醇 c. 四氯化碳
(4)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④步,⑥计算。
步骤⑤也被称做________操作,其目的是____________________________;
(5)重量分析法测定时,步骤③未在干燥器中进行,那么测得的晶体中所含结晶水含量________(填“偏高”、“偏低”或“无影响”);
(6)三草酸合铁(Ⅲ)酸钾晶体用重量分析法测定时,2.810g的晶体经操作最终获得了2.480g无水物,则此次测定的相对误差为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究 CO、CO2 的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)T1 K 时,将 1mol 二甲醚引入一个抽空的 50L 恒容容器中,发生分解反应:CH3OCH3(g) ![]() CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
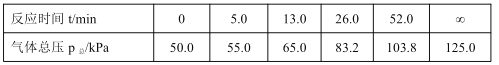
由表中数据计算:0~5.0 min 内的平均反应速率 v(CH3OCH3)=__________,该温度下平衡常数 K=_______________ 。
(2)在 T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4 混合气体发生如下反应:CO(g)+CH4(g) ![]() CH3CHO(g),反应速率 v正 v逆=k正p(CO)p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,
CH3CHO(g),反应速率 v正 v逆=k正p(CO)p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,![]() =____________。
=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101 kPa的条件下,相同质量的CH4和A气体的体积之比是15:8,则A的摩尔质量为___。
(2)两个相同容积的密闭容器X、Y,在25℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图示,试回答下列问题:
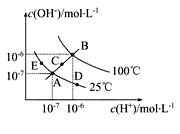
(1)图中五点Kw间的关系是_________。
(2)若从A点到D点,可采用的措施是_________。
A 升温 B 加入少量的盐酸 C 加入少量的NH4Cl
(3)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L 混合(设混合前后溶液的体积不变),所得混合溶液的pH=2,则 V1∶V2=________________。
(4)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=________mol·L-1(填数据)
(5)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=____________mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由 W、X、Y、Z 四种短周期元素组成,其中 W、Y、Z 分别位于三个不同周期,Y 核外最外层电子数是 W 核外最外层电子数的二倍;W、X、Y 三种简单离子的核外电子排布相同。下列说法不正确的是
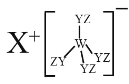
A.原子半径:W < X < Y < Z
B.X 与 Y、Y 与 Z 均可形成具有漂白性的化合物
C.简单离子的氧化性: W X
D.W 与 X 的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______。基态碳原子的核外电子占有______个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______。1mol PAN 中含有的σ键数目为______。组成PAN 的元素的电负性大小顺序为______。
②相同压强下,HCOOH 的沸点比 CH3OCH3______(填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+ 、H9O4 + 等微粒的形式。请画出 H5O2 的结构式:______。
(4)硅和碳在同一主族。下图为 SiO2 晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______nm。
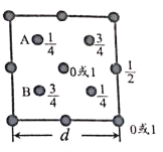 (d 的单位为 nm)
(d 的单位为 nm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com