
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图,下列说法正确的是( )
| X | Y |
| Z | W |
|
| A. | 非金属性:X<Y<Z |
|
| B. | W的原子序数可能是Y的原子序数的2倍 |
|
| C. | 气态氢化物稳定性:Y<W |
|
| D. | Z的化学活泼性一定比X 强 |
| 元素周期律和元素周期表的综合应用.. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | 根据X、Y、Z、W四种短周期元素在周期表中的相对位置知,X、Y位于第二周期,Z和W位于第三周期,X和Z位于同一主族、Y和W位于同一主族, A.同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱; B.W的原子序数比Y大8; C.非金属性越强,其氢化物越稳定; D.当X、Z为金属时Z的化学活泼性强,当当X、Z为非金属时Z的化学活泼性弱. |
| 解答: | 解:根据X、Y、Z、W四种短周期元素在周期表中的相对位置知,X、Y位于第二周期,Z和W位于第三周期,X和Z位于同一主族、Y和W位于同一主族, A.同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱,所以非金属性Z<X<Y,故A错误; B.W的原子序数比Y大8,W的原子序数可能是Y的原子序数的2倍,如O和S元素,故B正确; C.非金属性Y>W,其氢化物稳定性Y>W,故C错误; D.当X、Z为金属时Z的化学活泼性强,当当X、Z为非金属时Z的化学活泼性弱,故D错误; 故选B. |
| 点评: | 本题考查了位置结构性质的相互关系及应用,涉及元素周期表结构、元素周期律、原子结构等知识点,该题还考查学生发散思维能力,采用假设法进行解答,题目难度不大. |


科目:高中化学 来源: 题型:
已知2Na[Al(OH)4]+CO2===Na2CO3+2Al(OH)3↓+H2O 2Al(OH)3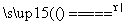 Al2O3+3H2O。某铝合金中含有镁、铜、硅,为了测定该合金中铝的含量,某同学设计如下实验:
Al2O3+3H2O。某铝合金中含有镁、铜、硅,为了测定该合金中铝的含量,某同学设计如下实验:
(1)取样品a g,称取时使用的主要仪器的名称为________。
(2)将样品溶于足量的稀盐酸中,过滤,滤液中主要含有的阳离子(H+除外)有________,滤渣中含有________,在溶解、过滤时,使用的玻璃仪器有____________________________________。
(3)在滤液中加入过量的氢氧化钠溶液,过滤,写出该步操作中有关反应的离子方程式____________________________________,
____________________________________________________。
(4)在第(3)步的滤液中通入二氧化碳,过滤。
(5)将第(4)步的沉淀洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。计算该样品中铝的质量分数是_____。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果偏________
(填“高”“低”或“无影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏________;若滤渣灼烧不充分,则实验结果偏________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。
反应的化学方程式是________________;样品中铝的质量是________g。
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是__________________________,氧化铁与铝的质量比是______。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比cb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示:
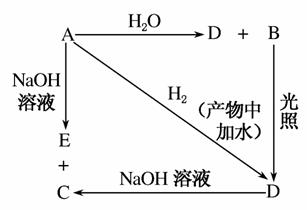
(1)请分别写出A、B、C、D、E的化学式(如为溶液请填溶质的化学式):
A________;B________;C________;
D________;E________。
(2)写出下列反应的化学方程式(请注明条件):
A+H2O_________________________________________。
A+NaOH_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法正确的是( )
|
| A. | 1mol OH﹣中含有9NA个电子 |
|
| B. | 28g的CO气体中含有NA个氧原子 |
|
| C. | 1L 1mol/L的AlCl3溶液中含有NA个Al3+ |
|
| D. | 常温常压下11.2 L的甲烷气体含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列顺序不正确的是( )
|
| A. | 热稳定性:HF>HCl>HBr>HI |
|
| B. | 微粒的半径:Cl﹣>Na+>Mg2+>Al3+ |
|
| C. | 电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3 |
|
| D. | 分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g)→2HF(g)+270kJ/mol,下列说法正确的是( )
|
| A. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
|
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ |
|
| C. | 该反应的逆反应是放热反应 |
|
| D. | 该反应过程的能量变化可用如图来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO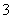 还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
①N2的结构式为________。
②上述反应离子方程式为________________,其平均反应速率v(NO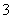 )为________mol·L-1·min-1。
)为________mol·L-1·min-1。
③还原过程中可生成中间产物NO ,写出3种促进NO
,写出3种促进NO 水解的方法__________________________。
水解的方法__________________________。
(2)电化学降解NO 的原理如图所示。
的原理如图所示。
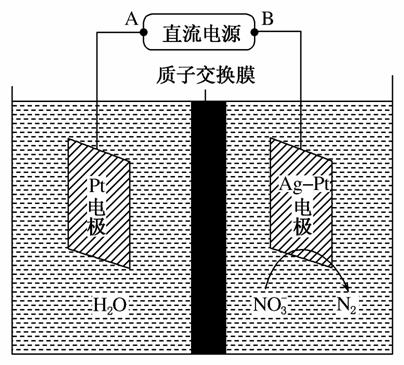
①电源正极为________(填“A”或“B”),阴极反应式为____________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的①CH4、②H2、③HCl、④SO2,在标准状况下所占体积由大到小排列的顺序是
A ②>①>③>④ B ④>③>①>②
C ③>②>④>① D ①>④>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com