
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
分析 铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol•L-1FeCl3溶液能溶解金属质量=1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
设出②中Fe、Cu的物质的量,根据②中剩余全部为Cu列式计算出Fe、Cu的物质的量,然后计算出二者质量之比.
解答 解:铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol•L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu,
(1)依据分析可知,实验一反应后溶液中含有Fe3+、Fe2+、Cu2+,
故答案为:Fe3+、Fe2+、Cu2+;
(2)实验②中剩余的0.64g全部为Cu,则溶解的Fe、Cu的总质量为:1.80g-0.64g=1.16g,
设溶解的Fe、Cu的物质的量分别为x+y,则$\left\{\begin{array}{l}{56x+64y=1.16}\\{2x+2y=0.04}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=0.015mol}\\{y=0.005mol}\end{array}\right.$,
则1.8g该混合物中含有Fe的质量为:56g/mol×0.015mol=0.84g,含有Cu的在为:1.8g-0.84g=0.96g,
则混合物中m(Fe):m(Cu)=0.84g:0.96g=7:8,
故答案为:7:8.
点评 本题考查混合物的计算,他们的浓重的,明确物质反应先后顺序及各组剩余固体成分是解本题关键,再结合转移电子守恒、原子守恒进行解答,同时考查学生思维缜密性.


科目:高中化学 来源: 题型:选择题
| A. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 若c(CH3COOH)=0.2mol/L,反应后的溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| D. | 若反应后的溶液呈中性,则:c(CH3COOH)+c(CH3COO-)>0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WO3和WO2.9是同分异构体 | |
| B. | 由WO3制备WO2.9的过程发生了氧化还原反应 | |
| C. | 18g H2O在WO2.9的高效催化下产生H2体积为22.4L | |
| D. | 利用这种新型催化剂分解水的同时可放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当x=2时,每生成lmolN2,转移电子数为4mol | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 等物质的量N2和C02中,共用电子对的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
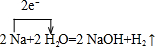 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AlCl3 | B. | Na2CO3 | C. | Na2SO3 | D. | MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
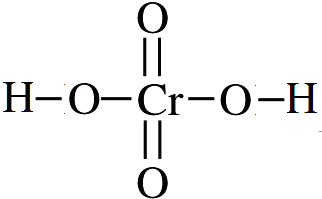 .
.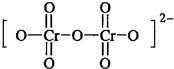
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com