
已知N2O4(g)?2NO2(g) △H>0且平衡体系的总质量(m总 )与总物质的量(n总)之比在不同温度下随压强变化曲线如图所示,下列说法正确的是( )

A.平衡常数K(a)=K(b)<K(c)
B.反应速率:va<vb ;
C.温度:T2>T1
D.当 =69g/mol时,若n(NO2):n(N2O4)=2:1,
=69g/mol时,若n(NO2):n(N2O4)=2:1,
B
【解析】
试题分析:反应N2O4(g)?2NO2(g) △H>0的正反应是吸热反应,在压强不变时,升高温度,平衡正向移动,气体的物质的量增大,平衡体系的总质量(m总 )与总物质的量(n总)之比减小。因此温度: T1 > T2。C 错误。化学平衡常数只与温度有关,而与压强无关。由于a、c在温度T2线上,b在温度T1线上。升高温度化学平衡正向移动,化学平衡常数增大,所以K(a)= K(c) < K(b)。A错误。由于b点的温度比a点高,压强比a点大,升高温度,化学反应速率加快;增大压强,化学反应速率加快,故化学反应速率va<vb 。B正确。D.若n(NO2):n(N2O4)=2:1,则m总 :n总=(46×2g+92g)÷3mol=61.33g/mol<69g/mol。错误。
考点:考查可逆反应的平衡常数、反应速率、温度及与气体的总质量和总物质的量的比的关系的知识。


科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:填空题
(12分)【化学一物质结构与性质】
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l。
(1)在第2周期中,第一电离能大于B的元素有____种。
(2)A的最简单气态氢化物分子的空间构型为________;H2B在乙醇中的溶解度大于H2C,其原因是_______。
(3)AB3,中,A原子轨道的杂化类型是_______ ,与AB3互为等电子体微粒的化学式
为________(写出一种即可)。
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程
式_______.
( 5)D2B的晶胞如图所示,已知晶体的密度为  ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含  、
、 的式子表示)。
的式子表示)。

查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:选择题
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
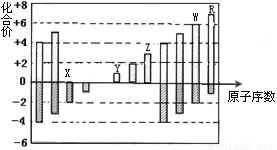
A.原子半径:Z>Y>X
B.气态氢化物的还原性:W>R
C.WX3和水反应形成的化合物是离子化合物
D.含Z的盐溶液一定显示酸性
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:选择题
相同温度,浓度均为0.1mol /L,等体积的三种溶液:①HF溶液、②CH3COOH溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)的变化如右图所示,下列说法正确的是( )

A.上述三种溶液中:c( OH-)大小:③ > ② > ①
B.物质酸性的比较:CH3COOH > HF > H2CO3
C.反应结束后所得两溶液中: c ( CH3COO - ) > c ( F- )
D.①和③反应结束后所得溶液中:c ( F- ) + c ( HF) = 0.10mol /L
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:实验题
(14分)锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业。碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰。某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(l)在第②步中,将上述固体与浓盐酸混合的目的是
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式 。
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2, MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3; 假设二:全部为Mn(OH)2; 假设三:
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成下表中的内容.
实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
将所得沉淀过滤、洗涤,
|
|
|
|
②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图.根据图中的数据判断假设三成立,理由是 
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:选择题
人们的生活、生产与化学息息相关,下列说法不正确的是( )
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.地沟油经过处理后可作为汽车燃油,故地沟油主要成分是液态烃
C.实施化石燃科脱硫,脱硝可以减少硫的氧化物和氮的氧化物的排放
D.雾霾天气中的主要污染物是PM2.5,其中含氮的有机物和光发生化学作用,可形成光化学烟雾
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
有A、B、X、Y四种短周期元素,其简单离子A+、B2+、X-、Y2-的电子层结构相同。则下列比较中正确的的是( )
A.原子序数:A>B>X>Y B.离子半径:A+ > B2+ > X- > Y2-
C.氢化物稳定性:H2Y > HX D.元素金属性:A > B
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:填空题
(13分)某研究性学习小组利用废旧铅蓄电池阴、阳极填充物------铅膏(含PbO、PbO2、PbSO4)制备电绝缘材料三盐基硫酸铅(3PbO?PbSO4?H2O),进行资源回收研究,设计实验流程如下:

(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明溶解度:PbSO4 (填“>”或“<”)PbCO3。
(2)步骤①中PbO2转化为PbCO3的离子方程式是(请配平此离子方程式):

(3)将步骤①和④的滤液合并,加入 PH=7,再经过 、冷却结晶、
、洗涤、干燥,可获得Na2SO4?10H2O晶体。
(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),步骤③中获得90.9 g PbSO4,则铅膏中PbO的质量分数为 (假设流程中原料无损失)。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,1mol乙烯共用电子对数为4NA
B.1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA
C.标准状况下,NA 个HF分子的体积约为22.4L
D.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com