
(10分)某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
Ⅰ.(1)10.0; (2)a、b、e ; Ⅱ.(1)环形玻璃搅拌棒、温度计;
(2) ①4.0;②-53.5 kJ·mol-1 ③A、C、D。
解析试题分析:Ⅰ. (1)若实验中大约要使用0.50 mol/L的 470 mL NaOH溶液,由于容量瓶规格与该体积最接近的是500ml,所以应该选择500ml容量瓶来配制,溶液有均一性,各处的浓度相等,所以至少需要称量NaOH固体的质量是m(NaOH)=(0. 5L×0.50 mol/L)×40g/mol=10.0g;(2)称量NaOH固体所需要的仪器有用药匙取药品,由于NaOH有腐蚀性,所以在烧杯中使用托盘天平进行称量,故选项是a、b、e; Ⅱ.测定中和热:(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒盐酸、NaOH溶液,尚缺少的实验玻璃用品是环形玻璃搅拌棒、温度计;(2)①在这四次实验中反应的温度变化分别是:5、6.1、3.9、4.1。可见第一次、第二次的误差太大,偏离真实值,舍去,平均温度是(3.9+4.1)÷2=4.0;②由于硫酸是二元酸,NaOH是一元碱,所以根据给定的浓度与溶液的体积可知酸过量,反应放出的热量应该按照碱来计算,所以该反应的中和热ΔH=-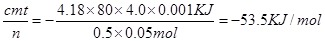 ;③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是A.实验装置保温、隔热效果差,使热量散失,正确; B.量取NaOH溶液的体积时仰视读数,则碱的物质的量增大,反应放出的热量增大,错误;C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,时间过长,热量散失的多,正确;D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,使反应开始的温度偏高,温度差偏小,反应热偏少,正确。
;③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是A.实验装置保温、隔热效果差,使热量散失,正确; B.量取NaOH溶液的体积时仰视读数,则碱的物质的量增大,反应放出的热量增大,错误;C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,时间过长,热量散失的多,正确;D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,使反应开始的温度偏高,温度差偏小,反应热偏少,正确。
考点:考查物质的量浓度的溶液的配制、酸碱中和热的测定、计算误差分析等有关知识。


科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:选择题
符合下列情况的化学反应一定能自发进行的是
A. △H<0、△S>0 B. △H<0、△S<0
C. △H>0、△S<0 D. △H>0、△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
分类是化学学习与研究的常用方法,下列分类正确的是 ( )
| A.Na2O、CaO、Al2O3均属于碱性氧化物 |
| B.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 |
| C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.烧碱、纯碱均属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
| A.若质量相等,则质子数相等 | B.若分子数相等,则体积相等 |
| C.若原子数相等,则中子数相等 | D.若体积相等,则密度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列原子结构模型与科学家对应不正确的一项是:
| A.阿伏加德罗的原子学说 |
| B.汤姆生的“葡萄干面包式”原子结构模型 |
| C.卢瑟福的带核原子结构模型 |
| D.玻尔的核外电子在一定轨道上运动的观点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
12分)某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
下几步:
A 移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B 用标准溶液润洗滴定管2-3次
C 把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面刻度
(1) 正确操作的顺序是(用序号字母填写) B- 。
(2) 滴定开始后,眼睛注视 ,判断滴定终点的现象是:
(3) 下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.工业上利用合成氨实现人工固氮 |
| B.SiO2有导电性,可用于制备光导纤维 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn具有还原性和导电性,可用作锌锰干电池的正极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
请回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出实验室制取A反应的离子方程式_______________。
(3)戊的分子式为_______。B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______。
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________。
(5)8gE在A中燃烧放出热量QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com