
| A. | 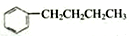 的与H2加成之后的产物中,其一氯代物有7种 的与H2加成之后的产物中,其一氯代物有7种 | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. |  的一溴代物和 的一溴代物和  的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
分析 A.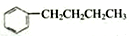 与氢气发生加成反应,苯环变为饱和六元环,有4种H,烃基有4种H;
与氢气发生加成反应,苯环变为饱和六元环,有4种H,烃基有4种H;
B.CH3CH=CHCH3具有乙烯的结构特点;
C. 主链为6,含有4个侧链,为甲基;
主链为6,含有4个侧链,为甲基;
D.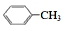 和
和 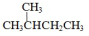 均含4种H.
均含4种H.
解答 解:A.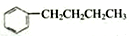 与氢气发生加成反应,苯环变为饱和六元环,有4种H,烃基有4种H,其一氯代物有8种,故A错误;
与氢气发生加成反应,苯环变为饱和六元环,有4种H,烃基有4种H,其一氯代物有8种,故A错误;
B.CH3CH=CHCH3具有乙烯的结构特点,碳原子的键角接近120°,故B错误;
C. 主链为6,含有4个侧链,为甲基,名称为2,3,4,4-四甲基基己烷,故C错误;
主链为6,含有4个侧链,为甲基,名称为2,3,4,4-四甲基基己烷,故C错误;
D.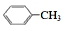 和
和 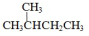 均含4种H,则一溴代物都有4种,故D正确;
均含4种H,则一溴代物都有4种,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应化学方程式为X(g)+Y(g)?M(g)+N(g) | |
| B. | 恒温恒容下,增大压强,N浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的焓变△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.其中X、Y、Z都为气体,反应在t1min时到达平衡,如图所示,下列说法正确的是( )
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.其中X、Y、Z都为气体,反应在t1min时到达平衡,如图所示,下列说法正确的是( )| A. | 该反应的化学方程式是2X=3Y+Z | |
| B. | 已知1molX完全反应要吸收46kJ的热量,则至t1min时,该反应吸收的热量为36.8kJ•mol-1 | |
| C. | 在此t1min时间内,用Y表示反应的平均速率v(Y)为0.6mol/(L•min) | |
| D. | 在相同状态下,反应前的压强是反应后的0.75倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量 NaOH 溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 加入过量粉:Fe3+、H+、Al3+、SO42- | |
| D. | 加入过量 NaNO3 溶液:Fe2+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化学键的键能是形成化学键时释放的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
化学键的键能是形成化学键时释放的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )| A. | -1 638 kJ•mol-1 | B. | 1 638 kJ•mol-1 | C. | -126 kJ•mol-1 | D. | 126 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (2)(5) | C. | (3)(5) | D. | (4)(6) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com