
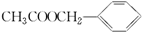 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: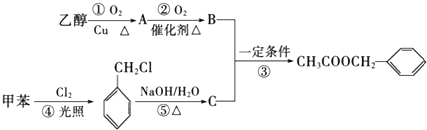
 ,B中含氧官能团的名称是羧基.
,B中含氧官能团的名称是羧基. ;
; .
.分析 由合成流程可知,乙醇在Cu或Ag催化作用下加热反应生成CH3CHO(A),CH3CHO继续被氧化为CH3COOH(B),甲苯光照下发生取代反应生成 ,
, 在碱性条件下水解生成C为
在碱性条件下水解生成C为 ,在一定条件下与CH3COOH发生酯化反应生成
,在一定条件下与CH3COOH发生酯化反应生成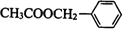 ,然后结合有机物的结构和性质解答该题.
,然后结合有机物的结构和性质解答该题.
解答 解:由合成流程可知,乙醇在Cu或Ag催化作用下加热反应生成CH3CHO(A),CH3CHO继续被氧化为CH3COOH(B),甲苯光照下发生取代反应生成 ,
, 在碱性条件下水解生成C为
在碱性条件下水解生成C为 ,在一定条件下与CH3COOH发生酯化反应生成
,在一定条件下与CH3COOH发生酯化反应生成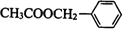 ,
,
(1)C的结构简式为 ,B中含氧官能团的名称是羧基,故答案为:
,B中含氧官能团的名称是羧基,故答案为: ;羧基;
;羧基;
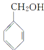
(2)实验室检验A的方法是取少量A溶液于试管中,向其中加入适量新制的银氨溶液,振荡后将试管放在热水浴中温热.一段时间后如试管内壁有银镜生成,说明被检者为A,故答案为:取少量A溶液于试管中,向其中加入适量新制的银氨溶液,振荡后将试管放在热水浴中温热.一段时间后如试管内壁有银镜生成,说明被检者为A;
(3)反应①的化学方程式为 ,反应⑤的化学方程式为
,反应⑤的化学方程式为 ,
,
故答案为: ;
; ;
;
(4)反应③的化学方程式 ,反应④的方程式为
,反应④的方程式为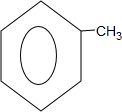 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl,均为取代反应,
+HCl,均为取代反应,
故答案为:取代反应;取代反应;
(5)由(3)和(4)中的反应可知生成物均不是一种,只有②发生2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,产物只有一种,原子的理论利用率为100%,符合“绿色化学”的要求,
故答案为:②.
点评 本题考查有机物的合成,为高频考点,把握合成流程中的反应、有机物的结构与性质、有机反应为解答的关键,侧重分析与推断能力的综合考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 甲、乙两烧杯中水电离出OH-浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向乙烧杯加入l0.0mL 0.1mol/L NaOH溶液后一定存在:c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
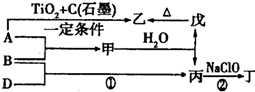
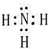 ,丁中所包含的化学键类型有bc(填字母序号).
,丁中所包含的化学键类型有bc(填字母序号).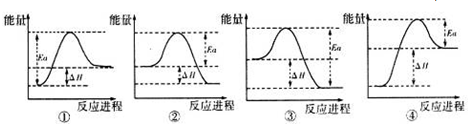
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 | |
| B. | 己烷和苯可以用酸性高锰酸钾溶液鉴别 | |
| C. | 甲烷和氯气反应生成一氯甲烷,苯和氢气反应生成环己烷,二者反应类型相同 | |
| D. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
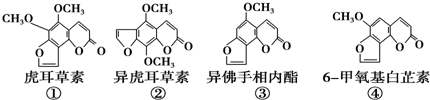
| A. | ②、③互为同系物 | |
| B. | ①、③各1mol与足量氢氧化钠溶液反应时均消耗3molNaOH | |
| C. | 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 | |
| D. | ③、④互为同分异构体,它们各1mol均能与5molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
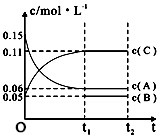
| A. | 若a=3,则b=1,c=2 | |
| B. | t1min时,该反应达到该条件下的反应限度 | |
| C. | 在O~t1min内,用C表示的化学反应速率为0.06mol•L-1 | |
| D. | B的起始浓度等于0.08mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,锂铝合金作负极,Li+向负极移动 | |
| B. | 充电时,阴极的电极反应式为:Fe+2Li2S-4e-=4Li++FeS2 | |
| C. | 该电池可用LiCl水溶液作电解质溶液 | |
| D. | 以Al作阳极,FeS为阴极,LiCl-KCl低共熔混合物为电解质进行电解,可以制得FeS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
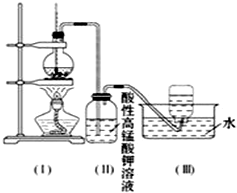 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | A | B | C | D | E | F | G | H |
| 原子半径/pm | 37 | 160 | 70 | 66 | 186 | 143 | 104 | 99 |
| 最高化合价 | +1 | +2 | +5 | +1 | +3 | +6 | +7 | |
| 最低化合价 | -3 | -2 | -2 | -1 |
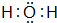 ,B、H两种元素形成化合物的电子式是
,B、H两种元素形成化合物的电子式是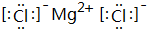 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com