
【题目】氧化还原反应在日常生活中有着广泛的应用,下列有关化学用语和相关说法均正确的是
选项 | 化学反应方程式 | 相关说法 |
A |
| 氧气是氧化产物,氯酸钾既是氧化剂又是还原剂 |
B | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
C | 4CuO | 该反应中每生成1molO2,则转移2NA个电子 |
D | 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑ | 氧化性:Na2O2>Na2FeO4>FeSO4 |
A.AB.BC.CD.D
【答案】D
【解析】
A. KClO3中Cl元素化合价从+5价降低到-1价,得到电子,化合价降低,被还原,KCl为还原产物,O元素由-2价升高到0价,失去电子,化合价升高,被氧化,O2为氧化产物,KClO3既是氧化剂又是还原剂,用双线桥表示电子转移为: ,A项错误;
,A项错误;
B. 反应Cl2+2Br-=2Cl-+Br2中,Cl元素化合价由0价降低到-1价,被还原,反应Zn+Cu2+=Zn2++Cu中,Zn由0价升高到+2价,被氧化,因此两反应并不都是单质被还原的置换反应,B项错误;
C. 反应4CuO![]() 2Cu2O+O2↑中Cu由+2价降低到+1价,O由-2价升高到0价,电子转移4e-,因此每生成1molO2,转移4NA个电子,C项错误;
2Cu2O+O2↑中Cu由+2价降低到+1价,O由-2价升高到0价,电子转移4e-,因此每生成1molO2,转移4NA个电子,C项错误;
D. 反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中氧化剂为Na2O2,氧化产物为Na2FeO4,FeSO4为还原剂,氧化剂的氧化性强于氧化产物的氧化性,因此氧化性的顺序为:Na2O2>Na2FeO4>FeSO4,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】已知C-C可以绕键轴旋转,结构简式为下图的烃,下列说法正确的是:
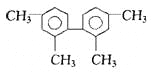
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.该烃的一氯取代物最多有3种
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其它条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.全部B.①③④⑤C.②③④⑤⑦D.③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的关系:
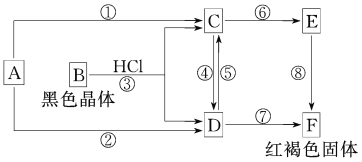
(1)确定A、B、C、D、E、F的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出⑧的化学方程式________,④、⑤的离子方程式________,_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相应的图像,判断下列相关说法错误的是
A.图①中,密闭容器中反应达到平衡,t0时改变某一条件,则改变的条件可能是加压(a+b=c)或使用催化剂
B.图②是达到平衡时外界条件对平衡的影响关系,则正反应为放热反应,p2>p1
C.图③是物质的百分含量和温度T关系,则反应为放热反应
D.图④是反应速率和反应条件变化关系,则该反应的正反应为吸热反应,且A、B、C、D一定均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣是生产金属铬和铬盐过程中产生的工业废渣,其中含有Na2SO4及少量Cr2O72—、Fe3+。从铬渣中提取Na2SO4的工艺流程:

已知:常温时,Fe3+、Cr3+完全沉淀时c≤1×10-5mol·L-1,Ksp[Fe(OH)3]=4×10-38,Ksp[Cr(OH)3]=6×10-31。
(1)调pH约为3.6目的是_________。
(2)根据下图溶解度(S)—温度(T)曲线,判断操作B为蒸发浓缩、_________________。
(3)“酸化、还原”步骤反应的离子方程式为_______________________________。
(4)滤渣D为________________________(填化学式)。
(5)如图,某工厂采用电解法处理含铬废水,用铁板作阴阳极,槽中盛放含铬废水,A接电源的_______极;阳极区溶液中发生的氧化还原反应为__________________。若不考虑气体的溶解,当收集到6.72L(标准状况)的H2时,理论上有___molCr2O72—被还原。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A. 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为(7/22.4)NA
B. 1 mol甲基(-CH3)所含的电子总数为9NA
C. 0.5 mol1,3-丁二烯分子中含有碳碳双键数为NA
D. 1 mol碳正离子(CH3+)所含的电子总数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氧化铜、氧化铁、氧化锌组成的混合物ag,加入2mol/L硫酸50mL时固体恰好完全溶解,若将ag该混合物在足量的一氧化碳中加热充分反应,冷却后剩余固体的质量为
A.1.6gB.(a-1.6)gC.(a-3.2)gD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属有机催化体系的发现和发展对有机合成策略的革新起到关键的决定性作用。最近,中国科学家采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物W的合成路线如下:
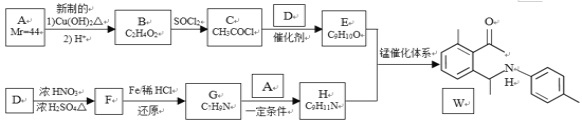
已知:①A为常见的有机物;D为苯的同系物,分子式为C7H8
②
回答下列问题:
(1)B中官能团的名称是__________,F的化学名称是____________。
(2)W的分子式为__________。
(3)D→F,E+H→W的反应类型分别是___________、_____________。
(4)A与银氨溶液加热反应的化学方程式为__________。C和D生成E的化学方程式为_________。
(5)芳香化合物L是E的同分异构体。若L能发生银镜反应,则L可能的结构有______种,其中核磁共振氢谱有四组峰的结构简式为__________(任写一种)。
(6)请以甲苯、丙酮(CH3COCH3)等为原料制备 ![]() ,写出相应的合成路线流程图(无机试剂任用)_________。
,写出相应的合成路线流程图(无机试剂任用)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com