
【题目】常温下,向20mL0.1mol/L氨水中滴加一定浓度的稀盐酸,溶液中水电离的氢离子浓度随加入盐酸体积的变化如右图所示。下列说法错误的是
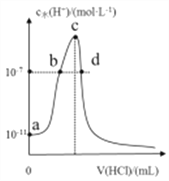
A. 常温下,0.1mol/L氨水的电离平衡常数Kb约为1.0×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)-)
D. c点溶质为NH4Cl
【答案】B
【解析】A项,氨水中存在微弱电离:NH3H2O![]() NH4++OH-,由图中A点可得,常温下0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=Kw/c(H+)=10-3mol/L,所以Kb=
NH4++OH-,由图中A点可得,常温下0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=Kw/c(H+)=10-3mol/L,所以Kb=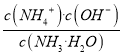 ≈
≈![]() mol/L=1×10-5mol/L,故A正确;B项,由图可知,a、b之间的点对应溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒c(NH4+)>c(Cl-),因为盐酸的量未知,所以不确定c(Cl-)与c(OH-)的大小关系,故B错误;C项,由图可知,c点c(H+)>10-7mol/L,溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒c(NH4+)<c(Cl-),故C正确;D项,因为氨水中水的电离被抑制,随着盐酸的加入,水的电离被抑制的程度逐渐减小,然后被促进,当溶质为NH4Cl时,水的电离被促进的程度最大,继续加入盐酸,水的电离被促进的程度逐渐减小,最后水的电离被抑制,由图可知,c点水的电离程度最大,所以c点溶质为NH4Cl,故D正确。
mol/L=1×10-5mol/L,故A正确;B项,由图可知,a、b之间的点对应溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒c(NH4+)>c(Cl-),因为盐酸的量未知,所以不确定c(Cl-)与c(OH-)的大小关系,故B错误;C项,由图可知,c点c(H+)>10-7mol/L,溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒c(NH4+)<c(Cl-),故C正确;D项,因为氨水中水的电离被抑制,随着盐酸的加入,水的电离被抑制的程度逐渐减小,然后被促进,当溶质为NH4Cl时,水的电离被促进的程度最大,继续加入盐酸,水的电离被促进的程度逐渐减小,最后水的电离被抑制,由图可知,c点水的电离程度最大,所以c点溶质为NH4Cl,故D正确。


科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是
①该氯原子的相对原子质量为12 a/b
②m g该氯原子的物质的量为m/(aNA) mol
③该氯原子的摩尔质量是aNA g
④a g该氯原子所含的电子为17 mol
A. ①② B. ②④ C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)0.7 mol H2O的质量为___________。
(2)___________mol H2O2所含原子数与0.2 mol H3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)a mol 氖气分子中所含电子数______________。(用NA表示)
(5)若某氯化钠溶液中,钠离子与水分子的物质的量之比为a : b,溶液的密度为d g/mL,则该氯化钠的物质的量浓度可表示为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气用途广泛。下面是以石油裂解气为原料合成CR橡胶和医药中间体K的路线:
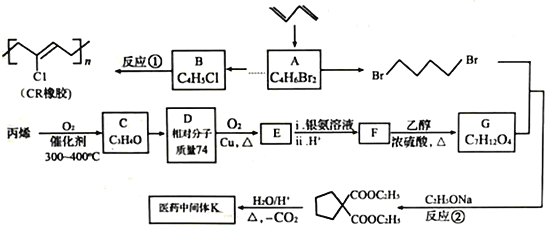
已知: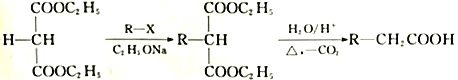
回答下列问题:
(1)A的顺式异构体的结构简式为________________,B的化学名称是________________。C分子中无环状结构,其官能团名称为____________________________。
(2)K的结构简式为____________,反应①、②的反应类型分别为_____________、_____________。
(3)D、E的结构简式分别为_____________、_____________。
(4)F与乙二醇发生聚合反应的化学方程式为_________________________________。
(5)写出同时满足下列条件的医药中间体K的所有同分异构体的结构简式:_________________________________________________。
a.与E互为同系物 b.核磁共振氢谱显示为3组峰
(6)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B,写出合成路线:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某市售盐酸试剂瓶上的部分数据:

(1)该市售盐酸的物质的量浓度为_________mol/L。(计算结果精确到小数点后1位,下同)
(2)欲配制1mol/L盐酸溶液475mL,则需量取该市售盐酸_____mL,除烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是________;下列情况会使所配溶液浓度偏高的是______(填序号)
A.量筒使用前用未干燥
B.用量筒量取浓盐酸时,俯视刻度线
C.量取出的浓盐酸露置较长时间后才加水稀释
D.洗涤量取浓盐酸的量筒,并将洗涤液转移到容量瓶中
(3)浓度均为1mol/L的盐酸与氢氧化钡溶液等体积混合后OH-的物质的量浓度=___________mol/L(忽略溶液体积变化);质量分数分别为36.5%和13.5%的盐酸等体积混合,所得溶液的质量分数__________25%(填“>”“<”或“=”);在标准状况下,1体积水吸收__________体积的HCl气体可制得36.5%的盐酸(水的密度以1.00g/cm3计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为________,其价层电子排布图为________。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为________。“摩尔盐”的分解产物中属于非极性分子的化合物是________。
(3)NH3的沸点比N2O的沸点________(填“高”或“低”),其主要原因是________。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为________,与CN—互为等电子体的单质的分子式为_________。HCN分子中σ键和π键的个数之比为________。
(5)FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为________,若该晶胞边长为acm,则该晶胞密度为________g/cm3。
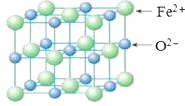
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列关于硝酸和硫酸的叙述中,错误的是( )
A.硫酸和硝酸都是重要的化工原料B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
C.稀硫酸和稀硝酸都具有氧化性D.浓硝酸和浓硫酸都具有很强的腐蚀性、脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由芳香烃X合成一种功能高分子H的过程如下。(部分产物、合成路线、反应条件略去)。
其中A是一氯代物,H的链节组成为C7H5NO
已知:I芳香烃X用质谱仪测出的质谱图如图所示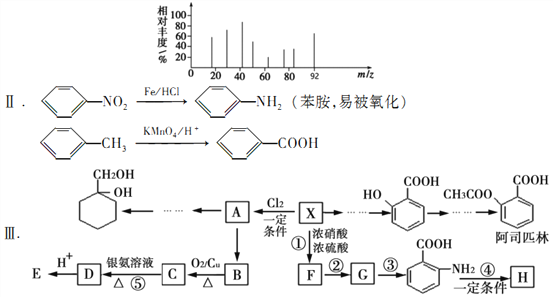
请根据所学知识与本题所给信息回答下列问题
(1)H的结构简式是_____________;(2)反应③和④的类型分别是_____________、_____________
(3)反应⑤的化学方程式是__________________________
(4)阿司匹林中含氧官能团的名称为__________________________
(5)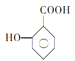 的一种同系物
的一种同系物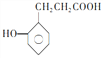 有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
①能与 NaHCO3反应放出CO2
②能与FeCl3溶液发生显色反应
③苯环上的一取代物有两种
(6)请用合成反应流程图表示出由A和其他无机物合成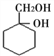 最合理的方案。_______________
最合理的方案。_______________
例: 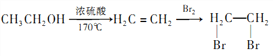 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com