
| A. | 偏大 | B. | 偏小 | C. | 不变 | D. | 无法判断 |
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A. | 含0.5 mol HCl的稀溶液与含 0.55 mol NaOH的稀溶液混合 | 测得放出热量为a kJ | 强酸与强碱反应的中和热为2a kJ/mol |
| B. | 向CuCl2、MgCl2的混合溶液中滴加NaOH溶液 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C. | 将铁钉和铜丝用导线连接后放入滴有酚酞的氯化铵溶液中 | 铜丝附近溶液变红色 | 铁发生吸氧腐蚀 |
| D. | 向某未知溶液中滴加酸性KMnO4溶液 | KMnO4溶液褪色 | 溶液中有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mol/L | D. | 0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 水电离的[H+]随着温度的升高而降低 | B. | 在35℃时,水电离的[H+]>[OH-] | ||
| C. | 水的电离程度:35℃>25℃ | D. | 水电离的[OH-]随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含2molFeBr2的溶液中通入1molCl2:2Fe2++Cl2═2Cl-+2Fe3+ | |
| B. | 向AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
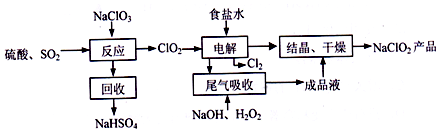
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率减慢,逆反应速率加快,化学平衡向逆反应方向移动 | |
| B. | 增大压强,正反应与逆反应速率均增大,平衡不移动 | |
| C. | 增大A2(g)的浓度,化学平衡向正反应方向移动,A2的转化率增大 | |
| D. | 增大B的物质的量,化学平衡向正反应方向移动,A2的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com