
��ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��SiCl4(g)+ 2H2(g)  Si (s)+ 4HCl(g) ��236kJ
Si (s)+ 4HCl(g) ��236kJ
���������գ�
��1����һ���¶��½���������Ӧ������Ӧ�������ݻ�Ϊ2L��H2��ƽ����Ӧ����Ϊ0.1mol/(L��min)��3min��ﵽƽ�⣬��ʱ��ù�������� g��
��2���÷�Ӧ��ƽ�ⳣ������ʽK�� ������ͨ��_______ʹK����
��3��һ�������£����ܱպ��������У��ܱ�ʾ������Ӧһ���ﵽ��ѧƽ��״̬���� ��
a��2v��(SiCl4)��v��(H2)
b���Ͽ�4molSi��Cl����ͬʱ������4molH��Cl��
c����������ܶȱ��ֲ���
d��c(SiCl4)��c(H2)��c(HCl)��1:2:4
��4������Ӧ������ͼ��ʾ���������ʾ�������Ȼ�������ʵ�����mol�����������ʾʱ�䣨min������������Ӧ����û�м������ȡ�����ʣ����1.5���Ӹı��������______����3���Ӹı��������__________����ƽ��̬������ת������С��ʱ�����_____________ ��
�����8�֣�33��2�֣�����1�֣�
��1��8.4
��2��K��c(HCl)4/c(SiCl4)��c(H2)2�����¡�
��3��ac
��4����ѹ�����£��ҼӴ�������1��1.5����
���������������1��m(Si)=1/2n(H2)M(Si)=1/2��0.1mol/(L��min)��2L��3miin��28g/mol=8.4g
��2��SiΪ���壬����K��c(HCl)4/c(SiCl4)��c(H2)2����Ϊ����ӦΪ���ȷ�Ӧ������ƽ�������ƶ���K����
��3��a��������������ȣ���ȷ��b���Ͽ�4molSi��Cl��˵����Ӧ��1molSiCl4������4molH��Cl��˵������4molHCl����������Ӧ��Ӧ������˵���ﵽƽ��״̬��c����������ܶȱ��ֲ��䣬˵�������������䣬�ﵽƽ��״̬����ȷ��d�������ʵ�Ũ��֮�����Ƿ�ƽ���أ�����
��4��1.5����H2���ʵ�����С��HCl���ʵ�������������б�ʼ�С��˵��ƽ��������Ӧ�����ƶ�����ѧ��Ӧ���ʱ�С�����Ըı�������Ǽ�Сѹǿ����3����ƽ��������Ӧ�����ƶ�����ѧ��Ӧ���ʱ�ı�����������£��ҼӴ���������Ϊ����ƽ�ⶼ�������ƶ�����������ת������С��ʱ���Ϊ��һ��ƽ��ʱ��Σ�1��1.5���ӡ�
���㣺���⿼�黯ѧ��Ӧ���ʵļ��㡢��ѧƽ�ⳣ������ѧƽ��״̬���жϡ�ͼ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������CO(g)+H2O(g) CO2(g)+H2(g)ij�о�С��ֱ��������Ϊ2L�ĺ����ܱ������м���һ�����ķ�Ӧ�ʹ�䷢����Ӧ������������£�
CO2(g)+H2(g)ij�о�С��ֱ��������Ϊ2L�ĺ����ܱ������м���һ�����ķ�Ӧ�ʹ�䷢����Ӧ������������£�
| ������� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���ʱ��/min | �ﵽƽ��ʱ��ϵ�����ı仯/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| �� | 650 | 1 | 2 | 0��4 | 0��4 | 5 | 16��4 |
| �� | 650 | 2 | 4 | | | t1 | Q1 |
| �� | 900 | 2 | 4 | 1��6 | 1��6 | t2 | Q2 |
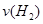 =__________��
=__________�� CO2(g)+H2(g) ��H= -41kJ/mol
CO2(g)+H2(g) ��H= -41kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⡣��֪��
CO(g)+H2O(g) H2(g)+CO2(g)ƽ�ⳣ�����¶ȵı仯���±���
H2(g)+CO2(g)ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
 H2(g)+CO2(g)������Ӧ��ƽ��ʱ��CO���������ΪX����ά��������������¶Ȳ��䣬��ʼ���ʰ�����������ȳ���������У��ﵽƽ��ʱCO���������������X����
H2(g)+CO2(g)������Ӧ��ƽ��ʱ��CO���������ΪX����ά��������������¶Ȳ��䣬��ʼ���ʰ�����������ȳ���������У��ﵽƽ��ʱCO���������������X���� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���º��������£�����Է�������ת�����䷴Ӧ���̺�������ϵ��ͼ1��ʾ��
(��֪��2SO2 (g)+O2(g) 2SO3(g) ��H=��196.6 KJ��mol-1��
2SO3(g) ��H=��196.6 KJ��mol-1��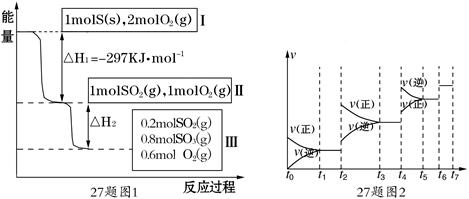
��ش��������⣺
��1��д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��2����H2 =
��3�����º���ʱ��1molSO2��2molO 2��ַ�Ӧ���ų���������ֵ�ȨO��H2 �O (�����С���� ����ȡ�)
��4�������еĻ������ͨ��������NaOH��Һ������NaOH�����ʵ���Ϊ ������Һ�з�����������ԭ��Ӧ����ù��̵����ӷ���ʽΪ ��
��5�����������£����д�ʩ����ʹn(SO3)/ n(SO2 )������� ��
a�������¶ȣ�
b������He��
c���ٳ���1molSO2 (g)��1molO 2 (g)
d��ʹ�ô���
��6��ijSO2 (g)��O2 (g)��ϵ��ʱ��t1�ﵽƽ��ı�ijһ�����������Ӧ����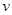 ��ʱ��t�Ĺ�ϵ��ͼ2��ʾ�������ı�SO2 (g)��O2 (g)��������ͼ��t4ʱ����ƽ���ƶ������������� ��ͼ�б�ʾƽ��������SO3�ĺ�����ߵ�һ��ʱ���� ��
��ʱ��t�Ĺ�ϵ��ͼ2��ʾ�������ı�SO2 (g)��O2 (g)��������ͼ��t4ʱ����ƽ���ƶ������������� ��ͼ�б�ʾƽ��������SO3�ĺ�����ߵ�һ��ʱ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͼ��ú������ҵ����һ���֣���������ѧ֪ʶ������������⣺
��1����֪�ò�ҵ����ij��Ӧ��ƽ�ⳣ������ʽΪ��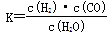 ��������Ӧ��Ӧ�Ļ�ѧ����ʽ��
��������Ӧ��Ӧ�Ļ�ѧ����ʽ��
_________________________________��
��2���ϳɼ״�����Ҫ��Ӧ�ǣ�2H2��g��+CO��g�� CH3OH��g��+90.8kJ��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
CH3OH��g��+90.8kJ��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
| ���� | H2 | CO | CH3OH |
| Ũ�ȣ�mol/L�� | 0.2 | 0.1 | 0.4 |
| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����裨Si3N4����һ�������մɲ��ϣ������ڸ����µĵ���������ʯӢ�뽹̿ͨ�����·�Ӧ�Ƶã�3SiO2(s) + 6C(s) + 2N2��g�� Si3N4(s) + 6CO(g) + Q��Q>0��
Si3N4(s) + 6CO(g) + Q��Q>0��
���������գ�
��1��ij�¶��¸÷�Ӧ��һ�ݻ�Ϊ2L���ܱ������н��У�2min��ﵽƽ�⣬�պ���2mol���ӷ���ת�ƣ���2min�ڷ�Ӧ������Ϊ��v(CO) = ���÷�Ӧ��ƽ�ⳣ������ʽΪ������������������ ��
��2��������������ʱ������ѹǿ���� ��
a��Kֵ��С��ƽ�����淴Ӧ�����ƶ�
b��Kֵ����ƽ��������Ӧ�����ƶ�
c��Kֵ���䣬ƽ�����淴Ӧ�����ƶ�
d��Kֵ���䣬ƽ��������Ӧ�����ƶ�
��3��һ����������˵��������Ӧ�Ѵ�ƽ������������� ��
a��c(N2 ) : c(CO) = 1��3 b��3v(N2 ) = v(CO)
c�������������ٸı� d�������ܶȲ��ٸı�
�ﵽƽ���ı�ijһ��������Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ��ʾ�� 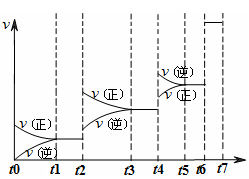
�����ı�N2��CO��������ͼ��t4ʱ����仯��ԭ������� ��ͼ��t6ʱ����仯��ԭ������� ��
��ͼ��֪��ƽ��������CO������ߵ�ʱ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������21������;���Ľṹ���Ϻ��ܲ��ϡ���ɷ���Ҫ��Fe������C��
��1����ҵ����������¯����CO�Ȼ�ԭFe2O3ұ������д���÷�Ӧ�Ļ�ѧ����ʽ���õ����ű�ʾ����ת�Ƶķ������Ŀ ��
��2����þ�Ͻ���Ŀǰ�ѷ��ֵĴ����ܶ���ߵĴ������֮һ���侧���ṹ��ͼ(�������Fe���������Mg)������þ�Ͻ�Ļ�ѧʽΪ ��
��3��Fe3���ĵ����Ų�ʽΪ ��CH3+��������ԭ���ӻ��������Ϊ ��
��4����һ������FeCl3��Һ�м�������KSCN��Һ����Һ���ɫ���÷�Ӧ��ϵ�д��ڻ�ѧƽ�� (�÷�Ӧʽ��ʾ)����������ɫ��Һ�м���Mg(OH)2���壬�ɹ۲쵽��Һ��ɫ��dz���к��ɫ��������������ƽ���ƶ�ԭ���������� ��(������SCN����Mg2+��Ӧ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ݷ�Ӧ��mA(g) + nB(g) pC(g) ��H�����ͼ����������Ϣ��ա�
pC(g) ��H�����ͼ����������Ϣ��ա�
���������������������
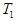 ______
______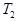
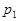 ______
______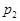
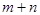 ______
______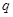
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
����ѧ�뼼����
��ҵ������Ϊԭ���Ʊ�����Ĺ�����ͼ1��ʾ��
ij����С��ģ���������ֹ����������ͼ2��ʾʵ��װ���Ʊ����ᣨ��������Ʒ���ѱ�������
��1����ҵ���ð�����ȡNO�Ļ�ѧ����ʽ�� ��
��2�����Ӻ�װ�ú����Ƚ��еIJ����� ��
��3��ͨ��a�����Ŀ���� ��
��4��ʢ��Na2CO3��Һ���ձ�Ϊβ������װ�ã���װ���з�����Ӧ�Ļ�ѧ����ʽ�� ��
��5����֪���¶ȵ���21.15��ʱ��NO2����ȫ��ת��ΪN2O4����ҵ�Ͽ���N2O4��ˮ��Ӧ�����������ʣ�N2O4��a��������ˮ����������Ļ�ѧ����ʽ�� ��
��6��һ�������£�ij�ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��c��NO2��=0.500mol/L��c��N2O4��=0.125mol/L����2NO2��g�� N2O4��g����ƽ�ⳣ��K= ����NO2��ʼŨ��Ϊ2mol/L����ͬ�����£�NO2�����ת����Ϊ ��
N2O4��g����ƽ�ⳣ��K= ����NO2��ʼŨ��Ϊ2mol/L����ͬ�����£�NO2�����ת����Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com