
【题目】下列说法正确的是( )
A.纯碱、烧碱一定是碱B.SiO2、SO2均属酸性氧化物
C.凡能电离出H+的化合物一定是酸D.盐类物质一定含有金属离子
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示) , 设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过mol电子。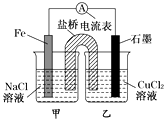
(2)用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 , 然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO ![]() ,试写出该反应的离子方程式。
,试写出该反应的离子方程式。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是溶液变红,电极反应为;乙装置中石墨(1)为极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为。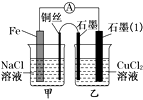
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为、。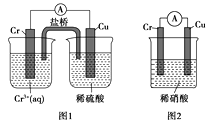
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:
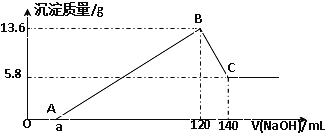
(1)写出OA段和BC段反应的离子方程式:
OA:________________________________ ; BC:_____________________________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
(5)a的值是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
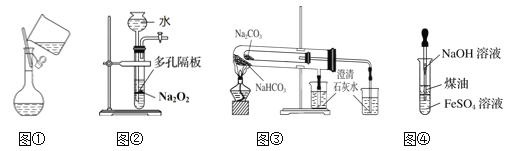
A. 图①向容量瓶中转移溶液
B. 图②用于Na2O2和H2O反应制取少量的O2
C. 图③比较碳酸钠和碳酸氢钠的热稳定性
D. 图④制备Fe(OH)2并能较长时间观察到白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 molL﹣1
D.生成的氢气在标准状况下的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶质的质量分数和物质的量浓度的计算结果错误的是( )
A. 密度为0.91g/cm3的氨水,质量分数为25%。该氨水用等体积的水稀释后,所得溶液中溶质的质量分数等于12.5%
B. 有K2SO4和Al2(SO4)3的混合溶液,已如其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为0.2mol/L
C. 将5mol/L的Mg(NO3)2溶液amL稀释至bmL,稀释后溶液中NO3-的物质的量浓变为![]() mol/L
mol/L
D. 将标准状况下,将VLA气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为![]() mol/L
mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com