
| A. | 碳酸钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 金属钠具有强的还原性,可利用钠和TiCl4溶液反应制取金属Ti | |
| C. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| D. | 硅酸钠水溶液呈碱性,可以用来制硅酸 |
分析 A.Na2CO3碱性太强;
B.在溶液中含有水,钠与水容易反应;
C.糖类分单糖、二糖和多糖,单糖不水解;
D.硅酸钠是弱酸强碱盐,呈碱性,并且硅酸的酸性比较弱.
解答 解:A.Na2CO3碱性太强,不宜做胃药,故A错误;
B.在溶液中含有水,钠与水容易反应,钠与TiCl4在高温下才能置换金属钛,故B错误;
C.糖类分单糖、二糖和多糖,单糖不水解,二糖、多糖、油脂、蛋白质在一定条件下均可以水解,故C错误;
D.硅酸钠是弱酸强碱盐,呈碱性,并且硅酸的酸性比较弱,可以用强酸制弱酸的方法来制硅酸,故D正确;
故选D.
点评 本题考查了元素化合物知识,明确各种物质的性质是解题关键,注意治疗胃酸过多用碳酸氢钠,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 第一种方法 | 四氯化碳 | |
| 第二种方法 | 硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ Cl- SO42- | B. | K+ Na+ Cl- HCO3- | ||
| C. | Fe2+ K+ NO3- SO42- | D. | K+ Ba2+ NO3- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
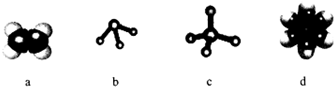
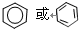 .
.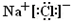 ,Na在F单质中燃烧的产物是Na2O2.
,Na在F单质中燃烧的产物是Na2O2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH)4-、Fe3+、HCO3- | |
| B. | 某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | |
| C. | 固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 | |
| D. | 加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com