
| A. | 乙酸和乙二醇 | B. | 乙醚和乙醇 | C. | 甲醛和乙酸 | D. | 乙醛和丙酮 |
分析 最简式即物质中各原子的最简单的整数比.写出各物质的分子式,进而写出最简式进行比较即可.
解答 解:A、乙酸的分子式为C2H4O2,最简式为CH2O,乙二醇的分子式为C2H6O2,最简式为CH3O,两者的最简式不同,故A错误;
B、乙醚的分子式为C4H8O2,最简式为C2H4O,乙醇分子式为C2H6O,最简式为C2H6O,两者的最简式不同,故B错误;
C、甲醛分子式为CH2O,最简式为CH2O,乙酸的分子式为C2H4O2,最简式为CH2O,最简式相同,故C正确;
D、乙醛的分子式为C2H4O,最简式为C2H4O,丙酮的分子式为C3H6O,最简式为C3H6O,故两者的最简式不同,故D错误.
故选C.
点评 本题考查了有机物的分子式和最简式的书写,较基础,写出分子式和最简式即可判断.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
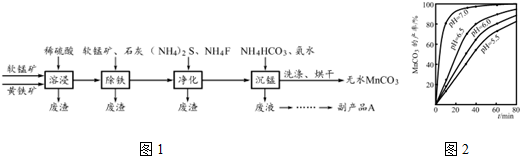
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
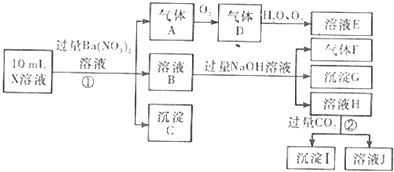
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
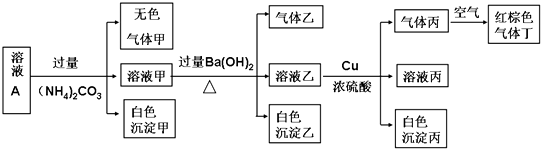
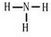
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶于稀盐酸中 2Fe+6H+═2Fe3++H2↑ | |
| B. | 钠和水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸钙与稀硝酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4与N2互为同位素 | |
| B. | N4H44+与NaOH溶液反应的离子方程式为N4H44++4OH-═N4+4H2O | |
| C. | N4H4(SO4)2为弱电解质 | |
| D. | N4H44+中只含有极性共价键,不含非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷的结构简式为CH3CH2CH2CH3 | B. | 一氯乙烷的结构式为CH3Cl | ||
| C. | 四氯化碳的电子式为 | D. | 苯的分子式为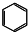 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com