
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: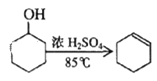 +H2O
+H2O
(1)制备粗品
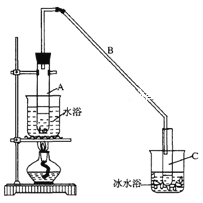
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至
反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是____________
② 试管C置于冰水浴中的目的是______________________________________________
(2)制备精品
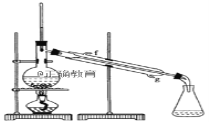
① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填:上、下),分液后用__________洗涤。
A KMnO4溶液 B 稀H2SO4 C Na2CO3溶液
② 再将环己烯按如图装置蒸馏,冷却水从_____口(填g或f)进入。
③ 收集产品时,控制的温度应在_____左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___________
a 蒸馏时从70℃开始收集产品 b 环己醇实际用量多了 c 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_____
A用酸性高锰酸钾溶液 B 用金属钠 C 测定沸点
【答案】冷凝 冷却,防止环己烯的挥发(或使环己烯液化,或其他合理答案) 上 C g 83℃ C B
【解析】
以醇与浓硫酸混合加热制烯烃的反应原理为基础制备环己烯的流程,环己醇在浓硫酸作用下加热到83℃生成环己烯,采用水浴加热,长导管有导出气体和冷凝的作用。分离环己烯的环己醇和酸性杂质,需要进行分液,然后用碳酸钠溶液洗涤,减少产品中的环己醇和酸性杂质,据此分析作答。
(1)①由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝,
故答案为:冷凝;
②生成的环己烯的沸点较低,放在冰水浴中可起到冷却,防止环己烯挥发的作用,便于环己烯的液化,故答案为:冷却,防止环己烯的挥发(或使环己烯液化,或其他合理答案);
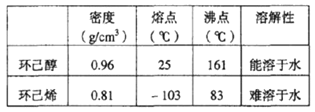
(2)①环己烯的密度比水小,在上层;由于分液后环己烯粗品中还含有少量的酸和环己醇,联想制备乙酸乙酯提纯产物时用Na2CO3溶液洗涤可除去酸,不能用酸性高锰酸钾,否则会氧化环己烯,故答案为:上;C;
②为了使冷凝的效果更好,冷却水从冷凝管的下口即g口进入;生石灰能与水反应生成氢氧化钙,除去了残留的水,得到纯净的环己烯;故答案为:g;
③根据表中数据可知,馏分环己烯的沸点为83℃,故收集产品应控制温度在83℃左右;
a. 蒸馏时从70℃开始收集产品,提前收集,产品中混有杂质,实际产量高于理论产量,故a项错误;
b. 环己醇实际用量多了,制取的环己烯的物质的量增大,实验制得的环己烯精品质量高于理论产量,b项错误;
c. 若粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量,c项正确;故选c;
故答案为:83℃;c;
(3)A. 环己醇与环己烯均使酸性高锰酸钾溶液褪色,A项错误;
B. 环己醇能和金属钠反应,但环己烯不能,B项正确;
C. 测定沸点的方法不能实现,C项错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系
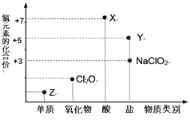
回答下列问题:
(1)X的电离方程式为________。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=______。
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为__;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,生成的两种盐的化学式分别__。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的__倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g氯化氢溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为m,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A.所得溶液的物质的量浓度为1mol/L
B.36.5 g氯化氢含有NA个原子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数为=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是( )

A. 分子中含有三种含氧官能团
B. 既能与FeCl3发生显色反应,也能和Na2CO3反应
C. 既可以发生取代反应,又能发生加成反应
D. 1 mol该化合物最多能与6molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是我校实验室化学试剂浓硫酸试剂标签上的部分内容。

现用该浓硫酸配制480mL1molL1的稀硫酸。可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒。请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有______(写仪器名称)。
(2)经计算,所需浓硫酸的体积约为______mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数______49%(填“>”、“<”或“=”)。
(3)对所配制的稀硫酸进行测定,发现其浓度大于1molL1,配制过程中下列各项操作可能引起该误差的原因______。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
⑴若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________L,V(H2)=________L.
⑵若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行反应:A2 +B2![]() 2AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是( )
2AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是( )
A. 气体的密度不再改变时
B. 气体的总物质的量不再改变时
C. 混合气体中各组分的含量不再改变时
D. 每消耗1molB2同时有2molAB生成时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
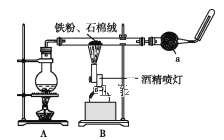

(1)已知该实验反应的反应方程式为:__Fe+__H2O![]() __Fe3O4+__H2(请配平)。
__Fe3O4+__H2(请配平)。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用图中__(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448L,则铁粉的转化率为___。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②___ | Ⅲ.反应后的溶液中阳离子___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为___色 | ①___ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) →Fe(s)+CO2(g)-Q,已知1100℃时,K=0.263
(1)写出该反应的平衡常数表达式____。温度升高,化学平衡移动后达到新的平衡,高炉中CO2和CO的体积比值___,平衡常数K值___(以上选填“增大”、“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0025mol/L、c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态___(选填“是”或“否”),此时,化学反应速率是v正___v逆(选填“大于”、“小于”或“等于”),其原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com