
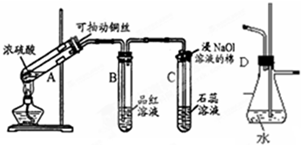
 根据如图所示实验回答下列问题:
根据如图所示实验回答下列问题:分析 (1)铜和浓硫酸加热条件下发生氧化还原反应生成硫酸铜和二氧化硫气体;二氧化硫有毒,需要用浸有氢氧化钠溶液的棉团吸收;
(2)二氧化硫具有漂白性,可使品红褪色;二氧化硫的漂白性是暂时的,加热后会恢复原色;
(3)通过调节铜丝的高度,控制参加反应的铜与浓硫酸的接触面积,从而控制SO2产生的量;
(4)依据当C堵塞时,气体不畅通,则在D中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管.
解答 解:(1)加热条件下,铜和浓硫酸发生氧化还原反应生成硫酸铜和二氧化硫气体,反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;由于二氧化硫是大气污染气体,不能排放到大气中,需要进行尾气处理吸收,所以浸氢氧化钠溶液的棉花团的作用是吸收二氧化硫,防止污染空气,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;吸收二氧化硫,防止污染空气;
(2)二氧化硫浸有漂白性,所以二氧化硫通过盛品红的B试管,品红溶液会褪色;二氧化硫的漂白作用是二氧化硫生成的亚硫酸与品红结合成不稳定的无色物质,加热会恢复红色,
故答案为:品红溶液褪色;无色变红色;
(3)通过抽动铜丝,以随时中止反应,避免浪费原料、减少污染气体的产生,
故答案为:抽动铜丝,以随时中止反应;
(4)D具有防止倒吸和检查是否发生堵塞的作用,当试管C发生堵塞时,D中压强不断增大,会导致D中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:D中水面会下降,玻璃管中的水柱会上升,甚至溢出.
点评 本题考查浓硫酸的性质,题目难度中等,注意掌握铜与浓硫酸的反应原理,明确二氧化硫的性质及检验方法,(4)为易错点,注意积累化学实验基本操作方法及解答化学实验题的方法与技巧.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=3的溶液与pH=11的溶液混合后pH值不一定等于7 | |
| B. | 同浓度的Na2CO3溶液室温时的pH值必定大于60℃的pH值 | |
| C. | 同浓度的钾盐溶液,酸式盐的pH值必定小于对应正盐的pH值 | |
| D. | 因为碳酸的酸性比亚硫酸弱,所以室温下同浓度的碳酸钠溶液的pH值小于亚硫酸钠溶液pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0~50秒,A物质化学反应速率v(A)=0.0016mo 1•L-1•S-1 | |
| B. | 250s时该反应达到化学平衡状态 | |
| C. | 若改加入2.0mol A,A的平衡转化率大于20% | |
| D. | 300K时,该反应的平衡常数为0.025 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温下向溶液中加CaO,溶液的pH升高 | |
| B. | 给溶液加热,溶液的pH升高 | |
| C. | 恒温下向溶液中加入CaO后,溶液中的c(OH-)不变 | |
| D. | 向溶液中加入少量的NaOH固体,Ca(OH)2固体的质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 推论 |
| A | H2O的沸点比H2S的沸点高 | 非金属性:O>S |
| B | 盐酸的酸性比H2SO3的酸性强 | 非金属性:Cl>S |
| C | 钾与水的反应比钠与水的反应更剧烈 | 金属性:Na>K |
| D | HF的热稳定性比HCl的强 | 非金属性:F>Cl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓硫酸共热至170℃;由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 乙醇与浓硫酸加热到140℃;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;溴乙烷与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com