
【题目】实验小组同学探究NH3与Cl2的反应,装置如图所示。常温常压下,将氨气收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K,按图连接好装置;将氨气压入反应管,充分反应后打开K。下列说法错误的是

A.反应开始后,保鲜袋逐渐被吸入反应管
B.反应过程中,反应管中产生白烟
C.打开K后,水会倒吸入反应管
D.上述反应原理可用于检验输送氯气的管道是否泄漏
【答案】C
【解析】
NH3与Cl2混合后,发生反应:8NH3+3Cl2==6NH4Cl+N2,40mLNH3与15mLCl2刚好完全反应,此时气体由55mL变为5mL,反应管内气体的压强减小,必然导致薄膜保鲜袋进入反应管,最终使反应管内气体的压强等于大气压强。
A.由上面分析可知,反应开始后,反应管内气体压强减小,保鲜袋逐渐被吸入反应管,A正确;
B.反应过程中,反应管中生成NH4Cl固体,悬浮于气体中,从而产生白烟,B正确;
C.打开K后,因反应管内气体的压强等于大气压强,所以水不会倒吸入反应管,C错误;
D.利用上述反应原理,可将蘸有浓氨水的玻璃棒靠近输送氯气管道中怀疑漏气的部位,从而根据有无白烟产生,判断管道是否泄漏,D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】在一定条件下,有下列物质:①8gCH4、②6.02×1023个HCl分子、③2mol O2。按由小到大的顺序填写下列空白(填写序号):
(1)摩尔质量____________________。
(2)物质的量____________________。
(3)分子数目____________________。
(4)原子数目____________________。
(5)质量____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如图所示。
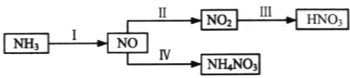
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是______。
(2)Ⅱ中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
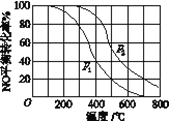
①比较p1、p2的大小关系:_______。
②随温度升高,该反应平衡常数变化的趋势是______。
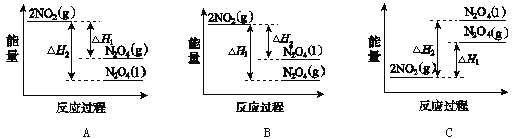
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2,下列能量变化示意图中,正确的是____(选填字母)。
N2O4(l) ΔH2,下列能量变化示意图中,正确的是____(选填字母)。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
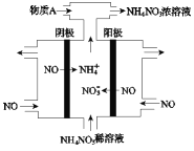
①写出阳极的电极反应式______
②为使电解产物全部转化为NH4NO3,需补充A。A是_____,说明理由:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应H2(g)+I2(g)![]() 2HI(g)达到化学平衡状态的标志是
2HI(g)达到化学平衡状态的标志是
A. 单位时间内生成nmolH2,同时就有nmolHI 生成
B. 单位时间内有nmolH2生成,同时就有nmolI2生成
C. 容器内气体的总压强不随时间的变化而变化
D. 容器内混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,v(A)=________,v(B)=________。
(2)化学方程式中,x=________,y=________,p=________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 NaOH溶液滴定NH4HSO4溶液 ,混合溶液的相对导电能力变化曲线如图所示,已知: Kb(NH3 H2O) =10-5,下列叙述正确的是
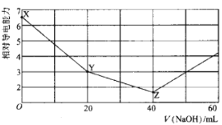
A.X→Y 过程中发生反应的离子方程式为:![]() +OH-= NH3 H2O
+OH-= NH3 H2O
B.Y点满足:c(![]() ) +c(Na+) =2c(
) +c(Na+) =2c(![]() )
)
C.水的电离程度:X>Y>Z
D.若Z点溶液pH=1l,则此时溶液中氨水浓度约为0.1 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜是人类历史上一项重大发明,它是铜(Cu)、锡(Sn) 和铅(Pb) 的合金,也是金属冶铸史上最早的合金 。 请回答 :
(1)基态Cu原子通过失去_____轨道电子转化为Cu+;Sn的原子序数为50,基态Sn原子的价层电子排布式为______。
(2)红氨酸(![]() ) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
(3)CuCl的盐酸溶液能吸收CO, 该反应可用于测定气体混合物中CO的含量,生成物M的结构如下图所示。
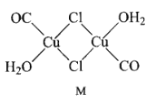
①与CO互为等电子体的离子为 _________(任写一种即可)。
②M中所有元素的电负性由大到小的顺序为 ____________。
③画图表示出M 中Cu原子形成的所有配位键_________。
(4)金属钙和铜的晶体结构相似,但铜的熔点比钙高,试分析其原因为___________。
(5)铜晶体中,Cu 原子之间会形成不同类型的空隙,比如下图铜晶胞中铜原子a1、a2、a3、a4 围成一个正四面体空隙 ,a2、a3、a4 、a5、a6、a7 围成一个正八面体空隙。
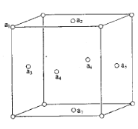
①铜晶体中,铜原子数:正四面体空隙数:正八面体空隙数=____。
②若a2 与a3 的核间距离为d pm, 阿伏加德罗常数的值为NA,则铜晶体的密度为___gcm-3( 列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则Kw________1×10-14(填“>”、“<”或“=”),做此判断的理由是___________________。
(2)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
![]() 离子化合物含离子键,也可能含极性键或非极性键
离子化合物含离子键,也可能含极性键或非极性键
![]() 硫酸的酸性大于碳酸的酸性,所以非金属性
硫酸的酸性大于碳酸的酸性,所以非金属性![]()
![]() 含金属元素的化合物不一定是离子化合物
含金属元素的化合物不一定是离子化合物
![]() 由非金属元素组成的化合物一定是共价化合物
由非金属元素组成的化合物一定是共价化合物
![]() 熔融状态能导电的化合物是离子化合物
熔融状态能导电的化合物是离子化合物
![]() 由分子组成的物质中一定存在共价键
由分子组成的物质中一定存在共价键
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com