
【题目】铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜![]() 含杂质
含杂质![]() 与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
![]() 溶液B经过________、__________、___________可得到氯化铜晶体;
溶液B经过________、__________、___________可得到氯化铜晶体;
![]() 检验溶液B中是否存在
检验溶液B中是否存在![]() 的方法是_________;
的方法是_________;
![]() 下列物质适合于调节溶液的pH得溶液B的是________
下列物质适合于调节溶液的pH得溶液B的是________
A.NaOH溶液 ![]()
![]() 氨水
氨水 ![]()
![]() 已知元素在高价态时常表现氧化性,若在酸性
已知元素在高价态时常表现氧化性,若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
【答案】蒸发浓缩 降温结晶 过滤 取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无![]() ,若溶液变红色,则存在
,若溶液变红色,则存在![]()
![]()
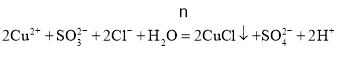
【解析】
粗铜![]() 含杂质
含杂质![]() 与过量氯气反应得FeCl3、CuCl2固体,用稀盐酸溶解得到FeCl3、CuCl2溶液,然后加试剂调节溶液的pH,将Fe3+转化为Fe(OH)3沉淀,从而得到CuCl2溶液。
与过量氯气反应得FeCl3、CuCl2固体,用稀盐酸溶解得到FeCl3、CuCl2溶液,然后加试剂调节溶液的pH,将Fe3+转化为Fe(OH)3沉淀,从而得到CuCl2溶液。
![]() CuCl2溶液经过蒸发、结晶、过滤,可得到氯化铜晶体;
CuCl2溶液经过蒸发、结晶、过滤,可得到氯化铜晶体;
![]() 检验CuCl2溶液中是否存在
检验CuCl2溶液中是否存在![]() 的方法是加入KSCN溶液;
的方法是加入KSCN溶液;
![]() A.加入NaOH溶液,不仅会使Fe3+转化为Fe(OH)3沉淀,也会将Cu2+转化为沉淀,且溶液中引入了Na+;
A.加入NaOH溶液,不仅会使Fe3+转化为Fe(OH)3沉淀,也会将Cu2+转化为沉淀,且溶液中引入了Na+;
![]() ,与溶液中的H+反应,增大溶液的pH,促进Fe3+水解成Fe(OH)3沉淀;
,与溶液中的H+反应,增大溶液的pH,促进Fe3+水解成Fe(OH)3沉淀;
![]() 加入氨水,溶液中会引入NH4+;
加入氨水,溶液中会引入NH4+;
![]() ,与溶液中的H+反应,增大溶液的pH,促进Fe3+水解成Fe(OH)3沉淀。
,与溶液中的H+反应,增大溶液的pH,促进Fe3+水解成Fe(OH)3沉淀。
![]() 若在酸性
若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加热,则Cu2+将SO32-氧化为SO42-,自身被还原为Cu+,Cu+与Cl-结合,生成CuCl沉淀。
和NaCl溶液,加热,则Cu2+将SO32-氧化为SO42-,自身被还原为Cu+,Cu+与Cl-结合,生成CuCl沉淀。
![]() 溶液B为氯化铜溶液,采用蒸发浓缩、降温结晶、过滤,可得到氯化铜晶体。答案为:蒸发浓缩、降温结晶、过滤;
溶液B为氯化铜溶液,采用蒸发浓缩、降温结晶、过滤,可得到氯化铜晶体。答案为:蒸发浓缩、降温结晶、过滤;
![]() 铁离子检验,采用KSCN试剂,操作为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无
铁离子检验,采用KSCN试剂,操作为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无![]() ,若溶液变红色,则存在
,若溶液变红色,则存在![]() 。答案为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无
。答案为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无![]() ,若溶液变红色,则存在
,若溶液变红色,则存在![]() ;
;
![]() 调节溶液pH,可以采用氧化铜、氢氧化铜、或者碳酸铜,消耗氢离子,并且不引入新的杂质。答案为:BD;
调节溶液pH,可以采用氧化铜、氢氧化铜、或者碳酸铜,消耗氢离子,并且不引入新的杂质。答案为:BD;
![]() 硫酸铜与亚硫酸钠发生氧化还原反应,生成氯化亚铜沉淀和硫酸钠,离子方程式为:
硫酸铜与亚硫酸钠发生氧化还原反应,生成氯化亚铜沉淀和硫酸钠,离子方程式为: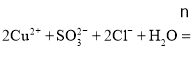
![]() 。答案为:
。答案为: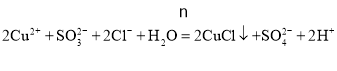 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为![]() 溶液和
溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
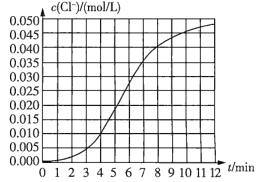
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() _______
_______![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表所示。
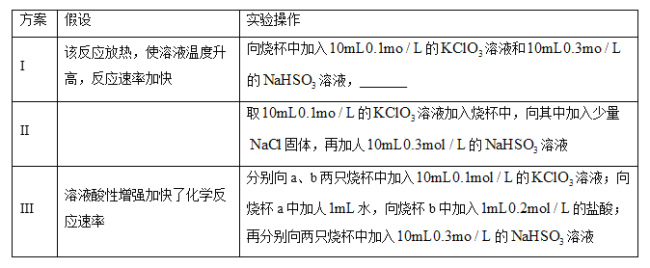
①补全方案I中的实验操作:_______。
②方案II中的假设为_______。
③除I、II、III中的假设外,还可以提出的假设是_______。
④某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:_______。
⑤反应后期,化学反应速率变慢的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01molL-1的NaOH溶液滴定20mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( )

A. Ka(HCN)的数量级为10-8
B. 点①时,向溶液中滴入几滴1mol/L的HCN溶液,溶液中c(H+)/ c(HCN)的值增大
C. 点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 在标示的四种情况中,水的电离程度最大的是②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
A.利用图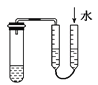 方法验证装置的气密性
方法验证装置的气密性
B.实验室里利用图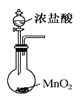 装置制备氯气
装置制备氯气
C.利用图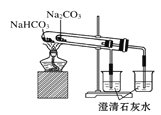 比较碳酸钠和碳酸氢钠的热稳定性
比较碳酸钠和碳酸氢钠的热稳定性
D.利用图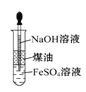 制备Fe(OH)2并能较长时间观察其颜色
制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡 H2O![]() H++OH-,向右移动且溶液呈酸性的是( )
H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO3溶液B.向水中加入 NH4Cl 溶液
C.向水中加入CH3COONa 溶液D.将水加热到 100℃,使 pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图,下列叙述不正确的是( )
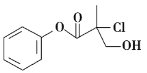
A.有机物A含有3种官能团
B.有机物A和NaOH的醇溶液共热可发生消去反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.有机物A能使溴水和酸性高锰酸钾溶液均褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com