
已知: CH4(g) + H2O(g) = CO(g) + 3H2(g) △H= +206kJ/mol
CO(g) + H2O(g) = CO2(g) + H2(g) △H= -41 kJ/mol
C—H、H—O、H—H的键能分别为413 kJ/mol、463kJ/mol、436 kJ/mol,
则CO2中C=O的键能为
A.797.5 kJ/mol B. 682 kJ/mol C.572 kJ/mol D.483 kJ/mol
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
有机物A由碳、氢、氧三种元素组成。现取3g A与4.48L(标准状况)氧气在密闭容器中充分燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰充分吸收,浓硫酸增重3.6g,碱石灰增重4.4g,剩余气体体积为1.12L(标准状况)。回答下列问题:
(1)3g A燃烧后生成物的物质的量分别为:
n(H2O)= ______,n(CO2)= ______,n(CO)= ______。(3分)
(2)通过计算确定A的分子式。(4分)
(3)写出A的一种可能的结构简式_______________________。(1分)
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO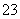 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 0.10 mol·L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产和生活中有着重要的应用,下列说法中不正确的是
A.明矾常做净水剂
B.与铜质水龙头连接处的钢质水管易发生腐蚀
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.金属钠着火时,可以使用泡沫灭火器来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
I.二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。
(1)工业上采用氯酸钠制备ClO2:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是 (填字母序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②当生成0.4molClO2时,转移电子 mol。
③若采用双氧水还原氯酸钠制备ClO2,更适合用于饮用水的消毒,其主要原因是 。
(2)ClO2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用ClO2
氧化除去CN-的离子方程式 。
II.下图甲是用H2还原 CO2制备甲醇的原电池工作原理示意图;图乙是用图甲作电源实现CO2制备碳氢化物的工作原理示意图(用KHSO4溶液作电解液)。
(1)图甲中A的电极名称是 。
(2)若乙中碳氢化物为C2H4, 则铜电极的电极反应为 。
(3)若通入的CO2全部参加反应,甲乙中共消耗0.6molCO2 时,图甲中通过质子交换膜的H+ 的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
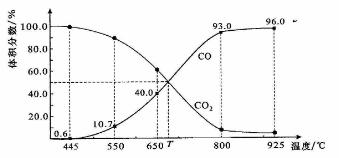
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是( )
A.550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
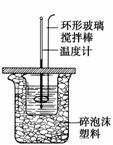
(1)大小烧杯间填满碎纸条的作用是
________________________________________________________________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将________(填“偏大”、“偏小”或“无影响”)。结合日常生活的实际该实验在______中进行效果更好。
(3)实验中改用60 m L 0.50 mol·L-1盐酸与 50 m L 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由__________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________;用50 m L 0.5 mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会
________________________________________________________________________。
(均填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com