
分析 (1)根据c=$\frac{1000ρω}{M}$计算出浓硫酸的物质的量浓度,再根据溶液稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;
(2)根据配制0.2mol•L-1的稀硫酸500mL的步骤选用仪器,然后判断还缺少的仪器;
(3)根据c=$\frac{n}{V}$分析解答.
解答 解:(1)量分数98%、密度为1.84g/cm3浓H2SO4的c=$\frac{1000×1.84g/L×98%}{98g/mol}$=18.4mol/L,配制450mL、0.2mol/L的稀H2SO4,应用500mL容量瓶,
则需浓H2SO4的体积为$\frac{0.5L×0.2mol/L}{18.4mol/L}$=0.0054L=5.4mL,
故答案为:5.4mL;
(2)根据配制500mL 0.2mol/L的稀硫酸步骤可知,需要选用的仪器为:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管,还缺少的仪器为:500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶、胶头滴管;
(3)①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸,稀释浓硫酸时,应该将浓硫酸缓缓加入水中,顺序不能颠倒,故①错误;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,热的溶液体积判断,冷却后溶液体积变小,配制的溶液浓度偏高;
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中,正确;
④转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量及溶液体积没有影响,不影响配制结果;
⑤定容时,俯视标线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
⑥定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致溶质的物质的量偏小,配制的溶液浓度偏低;
根据以上分析可知,错误的操作有:①②⑤⑥;能引起实验结果偏高的有:②⑤,
故答案为:②⑤.
点评 本题考查了配制一定物质的量浓度的溶液的方法,透明难度中等,试题基础性强,贴近高考,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


科目:高中化学 来源: 题型:填空题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用粗盐代替NaCl固体 | |
| B. | 定容时,溶液液面低于容量瓶刻度线 | |
| C. | 从烧杯向容量瓶转移溶液时,有少量溶液溅出 | |
| D. | 向容量瓶转移溶液时,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
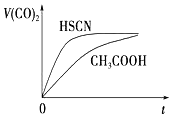 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
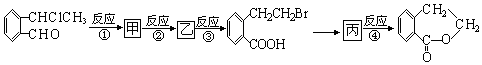
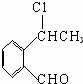 +O2$\stackrel{催化剂}{→}$2
+O2$\stackrel{催化剂}{→}$2 ,氧化反应.
,氧化反应. +NaOH$→_{△}^{CH_{3}CH_{2}OH}$
+NaOH$→_{△}^{CH_{3}CH_{2}OH}$ +NaCl+H2O,消去反应.
+NaCl+H2O,消去反应. →丙实际需要两步才能完成,写出第一步反应的化学方程式
→丙实际需要两步才能完成,写出第一步反应的化学方程式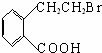 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$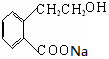 +NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.
+NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.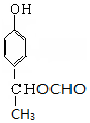 和
和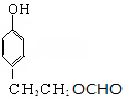 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯(CH2=CHCH3)易发生加成反应,一定条件下也可能发生取代反应 | |
| B. | 若有机物甲和乙是同分异构体,则甲和乙的化学性质相似 | |
| C. | 某有机物燃烧只生成物质的量之比为l:2 的CO2和H2O,说明其最简式为CH4 | |
| D. | 分子式分别为C2H6O、C3H8O的有机物一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中电能转化为化学能 | |
| B. | 反应低温可以自发转化 | |
| C. | 上述反应若使用催化剂,能改变反应的△H | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com