
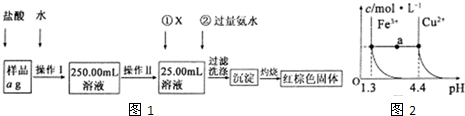
某氯化铁样品含有少FeC12杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
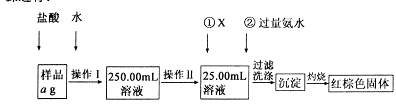
请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称),操作Ⅱ必须用到的仪器是 (填编号)。
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL酸式滴定管
(2)①的X可选用(填化学式),其目的是 。加入氨水要过量的原因是 。
(3)检验沉淀是否已经洗涤干净的操作是 。
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量W2g,则样品中铁元素的质量分数是 (列出计算式,不需化简):若固体加热时未充分反应,则最终测量的结果 (“偏大”、“偏小”、“不变”)。
(5)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图所示
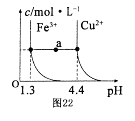 。
。
对图中a点的说法正确的是 (填序号)。
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上。
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的C(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和
(14分)(1)250ml容量瓶(1分) 胶头滴管(1分); D(1分)
(2)H2O2或Cl2或HNO3等(1分);使Fe2+被氧化为Fe3+(1分);使Fe3+成分沉淀(1分)
(3)取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净(其他合理答案均可)(2分)
(4) ×100%(2分);偏大(2分) (5)②(2分)
×100%(2分);偏大(2分) (5)②(2分)
【解析】
试题分析:(1)操作Ⅰ是配制一定物质的量浓度溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有250ml容量瓶和胶头滴管。操作Ⅱ是量取25.00ml溶液,需要滴定管。溶液显书写需要酸式滴定管,答案选D。
(2)由于溶液中含有亚铁离子,需要将其氧化生成铁离子,所以X应该是氧化剂,可以选择H2O2或Cl2或HNO3等。由于要使溶液中的铁离子完全沉淀生成氢氧化铁,所以加入的氨水应该是过量的。
(3)由于沉淀表面含有Cl-,所以可以通过检验Cl-来检验沉淀是否洗涤干净,即取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净。
(4)氢氧化铁分解生成氧化铁,则氧化铁的质量是(W2-W1)g,所以干净原子守恒可知,样品中铁元素的含量是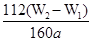 ×10×100%=
×10×100%= ×100%。若固体加热时未充分反应,则W2偏大,所以最终测量的结果偏大。
×100%。若固体加热时未充分反应,则W2偏大,所以最终测量的结果偏大。
(5)①、氯化铵固体溶于水,NH4+水解,溶液的酸性增强,pH降低,所以不可能使溶液由a点沿水平方向变到Cu2+曲线上,①不正确;②、温度不变,则溶液中水的离子积常数是不变的,②正确;③、a点均不在曲线上,其中铁离子已经完全沉淀,铜离子没有沉淀,是不饱和溶液,③不正确,答案选②。
考点:考查一定物质的量浓度的配制、仪器的选择、反应条件的控制、离子的检验、元素含量的测定与误差分析、离子积常数的应用与溶解平衡的判断等


科目:高中化学 来源: 题型:阅读理解

10(W2-W1)×
| ||
| a |
10(W2-W1)×
| ||
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:菏泽二模 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2013年山东省菏泽市高考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com