�±���ʵ�����Ʊ�������й����ݣ�
| ��� |
ʵ������ |
ʵ��ԭ�� |
����װ�� |
| ��1�� |
������ |
H2O2��O2 |
C C |
| ��2�� |
�ư��� |
NH4Cl��NH3 |
B B |
| ��3�� |
������ |
HCl��Cl2 |
A��C A��C |
��1�����������У��ӷ�Ӧ��������ת�ƵĽǶȿ������Բ�ͬ�������������
Cl2
Cl2
��д��ʵ������ȡ������Ļ�ѧ����ʽ
Ca��OH��
2+2NH
4Cl
CaCl
2+2NH
3+2H
2O
Ca��OH��
2+2NH
4Cl
CaCl
2+2NH
3+2H
2O
��
��2�����ݱ�������ʵ��ԭ����������װ����ѡ����ʵķ���װ�ã������������ϱ��Ŀո��У�
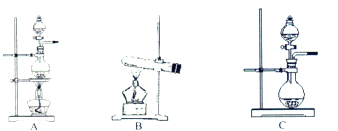
��3�����������Ʊ�O
2��װ���Ʊ�NH
3��Ӧѡ����Լ�Ϊ
Ũ��ˮ���������ƣ�����ʯ�һ��ʯ�ң�
Ũ��ˮ���������ƣ�����ʯ�һ��ʯ�ң�
��
��4����ŨCaCl
2��Һ��ͨ��NH
3��CO
2�����Ƶ�����̼��ƣ���ȡʱӦ��ͨ���������
NH3
NH3
����ȡ����̼��ƵĻ�ѧ����ʽΪ
CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl
CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl
������Ƽ�ʵ�鷽�����ж�����̼�����Ʒ�����Ƿ�Ϊ����
ȡ������Ʒ��ˮ����γɷ�ɢϵ����һ����Ӳ������䣬�����ֹ�����ͨ·����֤����Ʒ��������������
ȡ������Ʒ��ˮ����γɷ�ɢϵ����һ����Ӳ������䣬�����ֹ�����ͨ·����֤����Ʒ��������������
��
��5���Ʊ�Cl
2����8mol?L
-1������100mL������12mol?L
-1�����������ƣ�
����Ҫ����Ͳ��ȡ12mol?L
-1����������Ϊ
66.7
66.7
mL��
��ʵ�����ṩ������������Ϊ���������Ҫѡ�������Ϊ������ţ�
ACFGH
ACFGH
A��100mL��ͲB��������ƽC��������D��50mL����ƿ
E��10mL��ͲF����ͷ�ι�G��100mL�ձ�H��100mL����ƿ
������ʵ������У�����ȷ����
BC
BC
����д��ţ���
A��ʹ������ƿǰ��������Ƿ�©ˮ
B������ƿ������ˮϴ�������ô�����Һ��ϴ
C��������Һʱ������Ͳ��ȡŨ���Ტ�ز�������������ƿ�У�������������ˮ������̶���1��2cm�������ý�ͷ�ιܵμ�����ˮֱ����Һ�����͵�Ϳ̶�����ƽ
D�����ݺ�Ǻ�ƿ������ʳָ��סƿ��������һֻ����סƿ�ף�������ƿ��ת��ҡ����Σ�




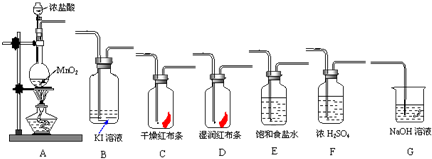

 I���±���ʵ�����Ʊ�������й����ݣ�
I���±���ʵ�����Ʊ�������й����ݣ�

