
| A、pH计 | B、胶头滴管 | C、滴定管 | D、量筒 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
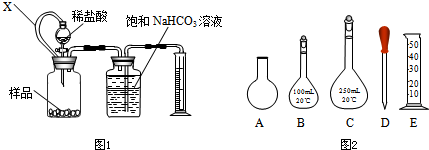
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
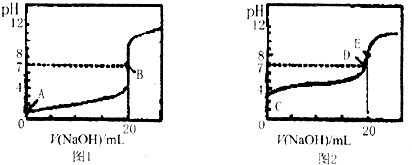
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气 中O2的体积百分数.| pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
| 液柱高度 | 0cm | 1.3cm | 8.5cm | 8.4cm | 8.5cm | 8.5cm |
| 形成稳定液柱时间 | 3.0min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | 17.5 min |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com