
| A. | 室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱 | |
| B. | 将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 | |
| C. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 | |
| D. | 加热除去NH4Cl中的少量NaHC03 |
分析 A.测定等浓度氨水和NaOH溶液的pH,NaOH溶液的pH大,可知电离程度大;
B.氨水缓慢滴入AlCl3溶液中,生成沉淀;
C.浓硫酸难挥发;
D.加热碳酸氢钠分解、氯化铵分解.
解答 解:A.测定等浓度氨水和NaOH溶液的pH,NaOH溶液的pH大,可知电离程度大,NaOH碱性强,则可比较氨水和NaOH碱性强弱,故A正确;
B.氨水缓慢滴入AlCl3溶液中,生成沉淀,氢氧化铝不能溶解,则不能研究Al(OH)3的两性,故B错误;
C.浓硫酸难挥发,利用将蘸有浓氨水和浓盐酸(或浓硝酸)的玻璃棒靠近,观察到白烟,故C错误;
D.加热碳酸氢钠分解、氯化铵分解,则加热不能除去NH4Cl中的少量NaHC03,故D错误;
故选A.
点评 本题考查化学反应中的规律及应用,为高频考点,把握反应原理、规律应用等为解答的关键,侧重分析与应用能力的考查,注意物质性质的综合应用,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有-OH的有机化合物性质相同 | |
| B. | 锅炉水垢中的CaSO4可用饱和Na2CO3溶液处理,使之转化为CaCO3后再用盐酸除去 | |
| C. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl) | |
| D. | 既有单质参加,又有单质生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
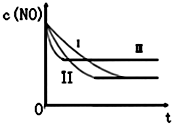 汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁燃烧发出耀眼的白光,可用来制造信号弹和焰火 | |
| B. | 碳酸氢钠能与酸反应,可用来治疗胃酸过多 | |
| C. | 利用铜与氯化铁溶液的反应来制作印刷电路板 | |
| D. | 铝制品表面有致密的氧化膜保护层,可长时间盛放咸菜等腌制食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | Na2CO3溶液中CO32-的水解:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com