
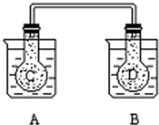
 如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00
如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00分析 (1)铵盐溶于水吸热;酸碱中和放热;
(2)由于A烧杯中溶液温度降低,故平衡2NO2(g)?N2O4(g)右移;由于B烧杯中反应放热,溶液温度升高,故平衡2NO2(g)?N2O4(g)左移,据此分析混合气体的颜色的变化;
(3)烧杯B 中盛有50.00ml 0.5mol/L的盐酸,物质的量n=CV=0.5mol/L×0.05L=0.025mol,后加入 2g 苛性钠固体即0.05molNaOH,故NaOH过量,反应生成0.025mol水,放热1.4325kJ,据此可以求出当生成1mol水时反应放出的热量,从而写出热化学方程式;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,求算反应掉的N2O4物质的量,再根据混合气体的平均相对分子质量$\overline{M}m=\frac{{m}_{总}}{{n}_{总}}$来计算.
解答 解:(1)铵盐溶于水吸热,故烧杯A中的温度降低;而酸碱中和放热,故烧杯B中的温度升高,故答案为:降低;升高;
(2)由于A烧杯中溶液温度降低,故平衡2NO2(g)?N2O4(g)右移,则混合气体的颜色变浅;由于B烧杯中反应放热,溶液温度升高,故平衡2NO2(g)?N2O4(g)左移,故混合气体的颜色的变深,故答案为:变浅;变深;
(3)烧杯B 中盛有50.00ml 0.5mol/L的盐酸,物质的量n=CV=0.5mol/L×0.05L=0.025mol,后加入 2g 苛性钠固体即0.05molNaOH,故NaOH过量,反应生成0.025mol水,放热1.4325kJ,故当生成1mol水时反应放出的热量Q=$\frac{1}{0.025}×1.4325KJ$=57.3KJ,故热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3KJ/mol,故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3KJ/mol;
(4)mg N2O4的物质的量n=$\frac{m}{92}$mol,设反应达平衡后有xmolN2O4发生了转化,则生成的NO2的物质的量为2xmol,剩余N2O4的物质的量为($\frac{m}{92}$-x)mol,根据反应平衡前后的压强之比等于物质的量之比可知:$\frac{\frac{m}{92}mol}{(\frac{m}{92}-x)mol+2xmol}$=$\frac{1.01KP}{1.515KP}$
解得x=0.0054mmol
则平衡混合气体的平均相对分子质量$\overline{M}$=$\frac{mg}{\frac{m}{92}mol+0.0054mmol}$=61.3g/mol.
故答案为:61.33.
点评 本题考查了常见的吸放热反应和物理过程以及平衡移动、热化学方程式书写、混合气体的平均相对分子质量的求算,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+物质的量浓度为0.2mol/L | B. | 溶液中含1mol NaOH | ||
| C. | 溶液中含4gNaOH | D. | 物质的量浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe2O3是红棕色粉末 | Fe2O3常用作红色涂料 |
| B | SiO2是两性氧化物 | SiO2可和HF反应 |
| C | Al2O3难溶于水 | Al2O3可用作耐火材料 |
| D | SO2有氧化性 | SO2可使溴水褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
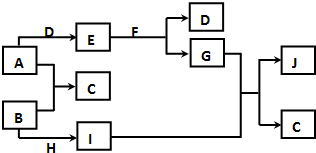 现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:
现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
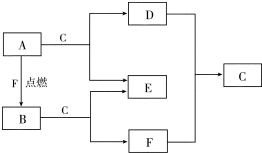 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | Y可以是葡萄糖 | |
| C. | CuSO4在1100℃分解所得混合气体X可能是SO2和SO3 | |
| D. | CuSO4可用于配制农药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com