
下列有关实验的做法正确的是
A.用pH试纸测氯水的pH
B.用托盘天平称取5.72 g NaCl晶体
C.用酸式滴定管量取20.00 mL的酸性KMnO4溶液
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
铁、铝、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题:
(1)铝的原子结构示意图为________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是________________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:________________________。
(3)如图K82所示的装置中,铁作________极,铜电极的电极反应式为________________。
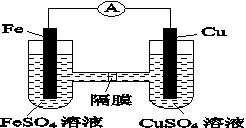
图K82
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热,并通入氯气,可得到氯化铝,同时生成CO。写出该反应的化学方程式:________________________________________。该反应中的氧化剂是________。
(6)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形。Q的各级电离能如下表,W与R是同族元素。
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
回答下列有关问题:
(1)W形成单质的晶体类型是_____________;其单核离子结构示意图为_____________。
(2)化合物Q2W2的电子式__________,化合物XYZ的结构式________________。
(3)Y与X形成式量最小,且分子中含有非极性键的分子式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如下图所示,下列有关叙述正确的是
A.①点所示溶液中只存在HClO的电离平衡
B.②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
C.I-能在②点所示溶液中存在
D.①到②水的电离程度逐渐减小
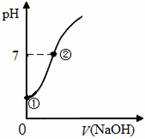
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积固定的密闭容器中进行可逆反应:2NO2 2NO+O2,下列情况中能作为反应达到平衡状态标志的是( )
2NO+O2,下列情况中能作为反应达到平衡状态标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
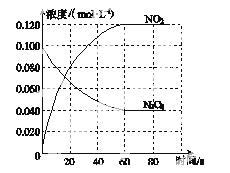
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是__________________ __________。
__________。
②列式计算温度T时反应的平衡常数K2:_______________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中发生反应:2X(g)+Y(g)  aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
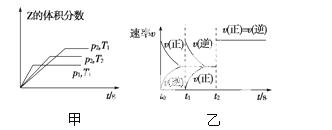
A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂或增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com