
![]()
(1)若X具有强氧化性,举两例分别写出对应的A、B、C的化学式(FeS2不能填写)。
例1:A________________,B________________,C________________。 例2:A_____________, B______________,C______________。
(2)若X为较活泼的金属,向C的水溶液中滴加硝酸银溶液有不溶于稀硝酸的白色沉淀析出,则B可能的化学式是_______________。若将铜片和碳棒用导线连接后插入B的水溶液中,构成原电池,写出负极的电极反应式:__________________________________________。
(3)若上述(2)中C溶液保存时需加入少量X,理由是____________________________。
(4)若A是一种常见的无机化合物,请写出反应①的化学方程式:(只要求写一例)
____________________________________________________________________。
(5)某工厂用含FeS260%的硫铁矿通过上述途径制取硫酸。已知反应①中S的损失率为2%,反应②中S的转化率为90%,则100 t硫铁矿可生产98%的浓硫酸__________吨。
(1)A:S B:SO
A:C B:CO C:CO2
(其他答案均可)
(2)FeCl3 Cu-2e-====Cu2+
(3)防止Fe2+被氧化
(4)4NH3+5O2![]() 4NO+6H2O(其他合理答案均可)
4NO+6H2O(其他合理答案均可)
(5)88.2
解析:(1)问,X具有强氧化性,可知A能被X连续氧化,若A为单质,则A对应元素至少有2个正价,这样的元素有S和C、N等。(2)问,C溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀析出,说明C含Cl-。若C中Cl-由B中氯元素还原生成,B中氯元素为0价、+1价、+3价、+5价、+7价均不合理,说明B为氯化物,B→C的氧化还原发生在金属元素X的不同价态之间,则X属于有多个价态的变价金属元素,据此进一步试探,X为Fe,A为Cl2,B为FeCl3,C为FeCl2时合理。C、Cu、FeCl3构成的原电池中,Cu作负极,负极电极反应式为Cu-2e-![]() Cu2+。(3)问,FeCl2溶液中加入少量Fe的目的是防止Fe2+被氧化。(4)问,A是常见无机化合物时,其能与物质X连续发生反应,A可为NH3与O2反应,还可为Ba(OH)2与CO2反应,等等。(5)问,设可得98%的浓H2SO4的质量为x。
Cu2+。(3)问,FeCl2溶液中加入少量Fe的目的是防止Fe2+被氧化。(4)问,A是常见无机化合物时,其能与物质X连续发生反应,A可为NH3与O2反应,还可为Ba(OH)2与CO2反应,等等。(5)问,设可得98%的浓H2SO4的质量为x。
FeS2—2SO2—2SO3—2H2SO4
120 t 2×98t
100 t×60%×(1-2%)×90% x·98%
x=![]() =88.2 t
=88.2 t


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:阅读理解
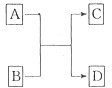 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题: →
→
 →
→


查看答案和解析>>
科目:高中化学 来源: 题型:
1.[化学—有机化学基础]
下列框图表示A、B、C、D、E、F、G、H、I各物质间的转化关系,已知有机物H分子中含有5个碳原子。有机物I是一种高分子材料。

已知R—CN![]() R—COOH
R—COOH
请回答下列问题:
(1)物质D和I的结构简式为:
D___________________,
I__________________。
(2)指出反应类型:反应④属___________,⑥属___________。
(3)写出下列反应的化学方程式:
反应②_______________________________________________________________。
反应⑦_______________________________________________________________。
(4)写出与H具有相同官能团且只含有一个甲基的同分异构体的结构简式(除H外,请写出任意两种)________________________,________________________。
2.[化学—物质结构与性质]
今有位于元素周期表短周期中的X、Y、Z三种元素。已知:
①三者原子序数之和为25;
②元素Y的原子价电子排布为ns2npn+2;
③X和Y在不同条件下可形成X2Y和X2Y2两种固态化合物,Y和Z在不同条件下可形成ZY和ZY2两种气态化合物;
④元素Z的硫化物与元素Z的氯化物,常温下均为液态,且二者的相对分子质量之比为38∶77。
据此填写下列空白:
(1)写出元素符号:
X____________;Y____________;Z____________。
(2)X2Y2属于___________晶体,构成晶体的微粒是________________(填微粒符号)。
(3)Z的硫化物的分子空间构型是_________________________,ZY2形成的晶体属于______________________晶体,根据原子轨道重叠方式的不同,Z的氯化物分子中含有的共价键种类及数目是__________________________。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期期中考试化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式 。
(2)用电子排布图表示F元素原子的价电子构型 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为 。
(4)离子半径D+ B3—,第一电离能B C,电负性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1∶1,X的电子式为 ,试写出Cu、稀H2SO4与X反应制备硫酸铜的离子方程式 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:江西模拟 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com