
48 22 |
50 22 |
A、
| ||||
B、
| ||||
C、
| ||||
D、分别由
|


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、摩尔是表示物质质量的单位 |
| B、摩尔是表示物质微粒数的单位 |
| C、摩尔是表示物质的量的单位 |
| D、摩尔是用来表示原子、分子的质量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 相关信息 |
| U | 所处的周期数、族序数分别与其原子序数相等. |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等. |
| W | 基态时,2P轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X第一电离能小于W的第一电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B、NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol?L-1 |
| C、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(S2-)+2c(HS-)+3c(H2S) |
| D、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、醋酸溶液除水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ |
| D、向NaAlO2溶液中滴加NaHCO3溶液HCO3-+AlO2-+H2O=A(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
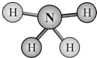 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )
肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )| A、肼分子中的氮原子采用sp3杂化 |
| B、肼分子中既有极性键又有非极性键 |
| C、肼分子是非极性分子 |
| D、肼与偏二甲肼互称同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
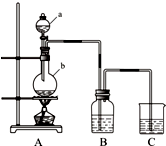 利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.据此回答:
利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:
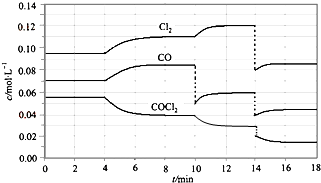 光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )
光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )| A、从第10 min到第12 min时,生成Cl2的速率v(Cl2)=0.01 mol?L-1?min-1 |
| B、第8 min时与第18 min时反应的平衡常数相同 |
| C、由于10 min时条件的改变,使COCl2的转化率降低 |
| D、在第14 min时,改变的条件可能是压缩反应容器的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com