
| ||
| 2min |
| ||||
| 2min |


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
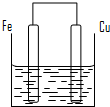
 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置.
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置.
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。
(1)铁片上的电极反应式为 ,铜片上的电极反应式为 ,铜片周围溶液会出现 的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,则导线中流过的电子为 mo1,该段时间内用硫酸铜表示的平均反应速率为 。
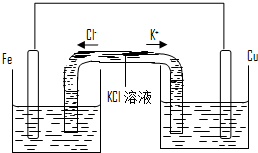
(3)若将该装置改为如下图所示的装置也能达到和原装置相同的作用,同时能保证停止使用该装置时反应物不损耗,KCl溶液起沟通两边溶液形成闭合回路的作用,则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中,若2 min内铁片减少了2.8g,则中间U形管中K+的流速是 mo1/min。(以上均假设反应过程中溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省新余一中高一下学期第六次段考化学试卷 题型:填空题
(12分)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。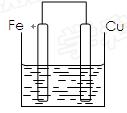
(1)铁片上的电极反应式为 ,铜片上的电极反应式为 ,铜片周围溶液会出现 的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,则导线中流过的电子为 mo1,该段时间内用硫酸铜表示的平均反应速率为 。
(3)若将该装置改为如下图所示的装置也能达到和原装置相同的作用,同时能保证停止使用该装置时反应物不损耗,KCl溶液起沟通两边溶液形成闭合回路的作用,则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中,若2 min内铁片减少了2.8g,则中间U形管中K+的流速是 mo1/min。(以上均假设反应过程中溶液体积不变)。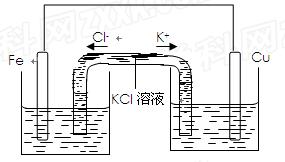
查看答案和解析>>
科目:高中化学 来源:2013届江西省高一下学期第六次段考化学试卷 题型:填空题
(12分)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。
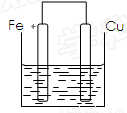
(1)铁片上的电极反应式为 ,铜片上的电极反应式为 ,铜片周围溶液会出现 的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,则导线中流过的电子为 mo1,该段时间内用硫酸铜表示的平均反应速率为 。
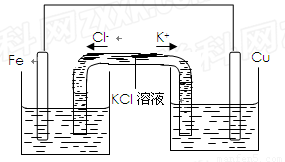
(3)若将该装置改为如下图所示的装置也能达到和原装置相同的作用,同时能保证停止使用该装置时反应物不损耗,KCl溶液起沟通两边溶液形成闭合回路的作用,则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中,若2 min内铁片减少了2.8g,则中间U形管中K+的流速是 mo1/min。(以上均假设反应过程中溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省盐城中学高一(下)期中化学试卷(解析版) 题型:解答题
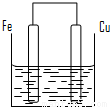
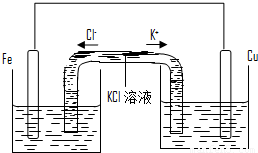
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com