


分析 (1)TiOSO4水解实际上是TiO2+水解;加入铁粉能将Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解;
(2)阴极上得电子发生还原反应;
(3)由流程图可知,硫酸亚铁与碳酸氢铵反应是碳酸亚铁,还生成气体为二氧化碳,溶液B为硫酸铵溶液;
(4)亚铁离子易被氧气氧化;
(5)根据乳酸生成乳酸亚铁的物质的量之比为2:1,设需要的乙烯的体积为Xm3,根据乙烯和乳酸之间的转化关系列式计算即可.
解答 解:(1)TiOSO4水解实际上是TiO2+水解,即TiO2+和水反应生成钛酸H4TiO4,根据质量守恒可知水解的离子方程式为:TiO2++3H2O═H4TiO4+2H+;加入铁粉能将Fe3+还原为Fe2+,且由于TiO2+是弱碱阳离子,铁粉的加入能消耗溶液中的H+促进TiO2+水解;
故答案为:TiO2++3H2O═H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连,电极反应式为TiO2+4e-=Ti+2O2-;
故答案为:TiO2+4e-=Ti+2O2-;
(3)由流程图可知,硫酸亚铁与碳酸氢铵反应是碳酸亚铁,还生成气体为二氧化碳,副产品为硫酸铵溶液,反应离子方程式为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,故答案为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑; (NH4)2SO4;
(4)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(5)根据乳酸生成乳酸亚铁的物质的量之比为2:1,设需要的乙烯的体积为Xm3,由于乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生成468Kg乳酸亚铁所需的乙烯的量之间有:$\frac{1000xL}{22.4L/mol}×\frac{1}{2}$=$\frac{\frac{468000g}{234g/mol}}{0.9}$,解得x=99.6,故答案为:99.6.
点评 本题综合考查物质性质、电极反应的书写等,要求学生具有一定分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NO3-、Cl-、K+ | B. | Cu2+、NH4+、Br-、OH- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | K+、Ba2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
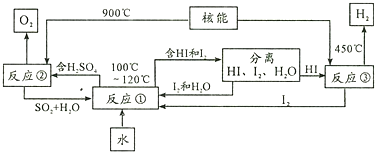
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
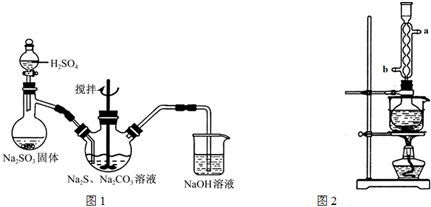
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③>①>④>② | B. | ①>②>③>④ | C. | ③>②>①>④ | D. | ①>④>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mol | B. | 10 mol | C. | 5 mol | D. | 30 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com