
【题目】某地有软锰矿(主要成分 MnO2,含少量 SiO2 和 Al2O3)和闪锌矿(主要成分 ZnS,含少量 FeS、CuS 和 CdS)两座矿山。综合利用的工艺如下,主产品是通过电解获得的锌和二氧化锰,副产品为硫磺、少量金属铜和镉。生产中除矿石外,只需购入少量的硫酸和纯碱。
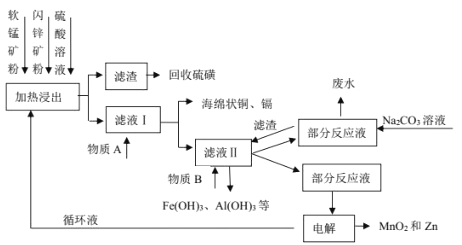
(1)以 FeS 为例,写出生成硫磺的反应方程式____。
(2)回收的硫磺可用于制取石硫合剂:在反应器内加水使石灰消解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是________________,残留的固体杂质可能是_________________。
(3)写出物质 A 和 B的化学式_____、_____。
(4)不在滤液Ⅱ中直接加入 Na2CO3 的原因是_____。
(5)电解时的阴极材料为_____,阳极的电极反应式为_______________。
(6)已知 H2CO3 的 Ka1=4×10-7,Ka2=5×10-11,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液的 pH 约为___________(lg4=0.6,lg5=0.7),溶液中含碳微粒的浓度从大到小的顺序为_____向此溶液中不断滴加 1mol/L 稀 HCl 时,溶液中 c(CO32-)的变化曲线如下图所示,请在图中画出溶液中其它含碳微粒浓度变化的曲线。_________________________

【答案】3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S↓+6H2O CaSO3 CaCO3 或(和)CaSO4 Zn MnO2 防止带入 Na+等杂质 纯锌(或 Zn) Mn2++2H2O-2e-=MnO2+4H+ 10.3 HCO3->CO32->H2CO3(或CO2) 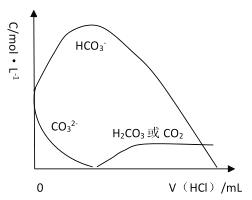
【解析】
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O;
(2)硫发生歧化反应,生成低价硫化物如CaS等和高价硫的含氧酸盐如CaSO3、及其氧化产物CaSO4等;
(3)滤液1中加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd;物质B中MnO2,其作用是将Fe2+氧化为Fe3+;
(4)再加入Zn(OH)2等再调节溶液pH,使Fe3+、Al3+转化为沉淀而除去,并且不能引入杂质,另外物质可以是Zn(OH)2、Mn(OH)2、ZnCO3、MnCO3等难溶固体;故不用Na2CO3 的原因是防止带入 Na+等杂质;
(5)阳极Mn2+失电子发生氧化反应,生成MnO2;
(6)0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中,CO32-水解大于HCO3-,据此可以判定混合液中离子浓度大小关系;Na2CO3 和 NaHCO3 的混合溶液显碱性,以碳酸钠水解为主,根据水解平衡常数、碳酸的Ka2可以计算出c(OH-),进而求出c(H+),从而求出pH;Na2CO3 和 NaHCO3 的混合溶液不断滴加 1mol/L 稀 HCl 时,先发生CO32-+H+=HCO3-,再发生HCO3-+H+=H2CO3,溶液中 c(CO32-)的变化曲线如下图所示,浓度先增大后变小,据此画图。
(1)MnO2在酸性溶液与FeS反应生成硫酸铁、硫酸锰、S与水,生成硫磺的反应方程式3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S↓+6H2O。
故答案为:3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S↓+6H2O;
(2)在反应器内加水使石灰溶解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,生成低价硫化物如CaS等和高价硫的含氧酸盐如CaSO3、及其氧化产物CaSO4等,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是CaSO3 ,残留的固体杂质可能是 CaCO3 或(和)CaSO4。
故答案为:CaSO3 ; CaCO3 或(和)CaSO4;
(3)滤液1中加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd;物质B中MnO2,其作用是将Fe2+氧化为Fe3+;物质 A 和 B的化学式 Zn、MnO2。
故答案为: Zn;MnO2;
(4)再加入Zn(OH)2等再调节溶液pH,使Fe3+、Al3+转化为沉淀而除去,并且不能引入杂质,不在滤液Ⅱ中直接加入 Na2CO3 的原因是防止带入 Na+等杂质。
故答案为:防止带入 Na+等杂质;
(5)电解时的阴极材料为纯锌(或 Zn),阳极Mn2+失电子发生氧化反应,生成MnO2,阳极的电极反应式为:Mn2++2H2O-2e-=MnO2+4H+。
故答案为:纯锌(或 Zn);Mn2++2H2O-2e-=MnO2+4H+ ;
(6)已知 H2CO3 的 Ka1=4×10-7,Ka2=5×10-11,得的水解常数为:![]() ,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中c(HCO3-)=c(CO32-),即c(OH-)=
,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中c(HCO3-)=c(CO32-),即c(OH-)=![]() =2×10-4,pH=-lg5×10-11=10+lg2=10.3;0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中,CO32-水解大于HCO3-电离,溶液中含碳微粒的浓度从大到小的顺序为;HCO3->CO32->H2CO3(或CO2);向此溶液中不断滴加 1mol/L 稀 HCl 时,先发生CO32-+H+=HCO3-,再发生HCO3-+H+=H2CO3,溶液中 c(CO32-)的变化曲线如下图所示,浓度先增大后变小,H2CO3在CO32-+H+=HCO3-后逐渐增大 ,其含碳微粒浓度变化的曲线。
=2×10-4,pH=-lg5×10-11=10+lg2=10.3;0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液中,CO32-水解大于HCO3-电离,溶液中含碳微粒的浓度从大到小的顺序为;HCO3->CO32->H2CO3(或CO2);向此溶液中不断滴加 1mol/L 稀 HCl 时,先发生CO32-+H+=HCO3-,再发生HCO3-+H+=H2CO3,溶液中 c(CO32-)的变化曲线如下图所示,浓度先增大后变小,H2CO3在CO32-+H+=HCO3-后逐渐增大 ,其含碳微粒浓度变化的曲线。 ;
;
故答案为:10.3;HCO3->CO32->H2CO3(或CO2);


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
B.对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
C.氨水中加入NaOH固体有利于氨气的溢出
D.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种淡黄色粉末,易溶于水,不溶于乙醇。在实验室制备连二亚硫酸钠流程如下:
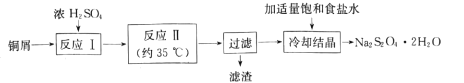
(1)反应Ⅰ是制备SO2,下图装置可制取纯净干燥的SO2:
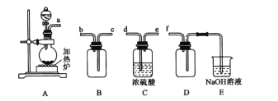
①按气流方向连接各仪器接口,顺序为a→ ___→f,装置D的作用是______。
②装置A中反应的化学方程式为___。
(2)反应Ⅱ所用实验装置如图所示(部分装置省略)。
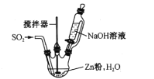
①通SO2之前先强力搅拌,将锌粉和水制成悬浊液,其目的是_________;控制反应温度的方法是____
②反应Ⅱ的离子方程式为 ___。
(3)“滤渣”经洗涤、灼烧,可得到一种工业产品是____(填化学式);加入适量饱和食盐水的目的是 ___。
(4)产品Na2S2O42H2O久置空气中易被氧化,其氧化产物可能是_______(写2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的表达式正确的是
A. 乙炔分子的比例模型示意图:![]()
B. 2-甲基-2-戊烯的键线式:![]()
C. ![]() 的名称:3-甲基-1-丁烯
的名称:3-甲基-1-丁烯
D. 1,3-丁二烯的分子式:C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是__填序号。
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子都任同一条直线上,则A的结构简式为__。
(3)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1molA最多可与1molH2加成,则A的名称是__。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治疗帕金森病的新药沙芬酰胺的合成方法如下:

已知:
①CH3CN 在酸性条件下可水解生成 CH3COOH。
②CH2=CH-OH 和 CH3OOH 均不稳定。
(1)C 生成 D 的反应类型为_______________。G中含氧官能团的名称为_____。B 的名称为_____。
(2)沙芬酰胺的结构简式为_____。
(3)写出反应(1)的方程式_____。分析反应(2)的特点,写出用福尔马林浸制生物标本的反应原理的方程式_____(蛋白质的结构用![]() 表示)。
表示)。
(4)H 是 F 相邻的同系物,H 的苯环上有两个处于对位的取代基,符合下列条件的 H 的稳定的同分异构体共有_____种。
①苯环上仍然有两个处于对位的取代基;
②能与 NaOH 溶液反应;
(5)下图是根据题中信息设计的由丙烯为起始原料制备 B 的合成路线,在方框中补全必要的试剂和中间产物的结构简式(无机试剂任选,氧化剂用[O]表示,还原剂用[H]表示,连 续氧化或连续还原的只写一步)。________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,在催化剂存在时反应过程中的能量变化如图所示。下列叙述正确的是
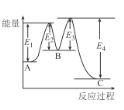
A.△H=E2-E1+E3-E4
B.加入催化剂后反应经过两步完成,其中第一步反应决定总反应速率
C.加入催化剂,△H、反应速率均发生改变
D.向密闭容器中充入3 mol H2和1molN2,发生上述反应,达到平衡时,反应放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢氧燃料电池是符合绿色化学理念的新型发电装置,如图1为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
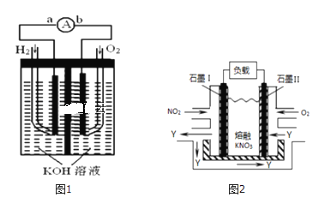
(1)负极反应式为______.
(2)电极表面镀铂粉的原因为______.
II.分析下列电解过程:
(1)写出惰性电极电解CuSO4溶液的总反应的离子方程式:______;
(2)写出惰性电极电解NaCl溶液的阳极反应式______;电解一段时间后加______(填物质名称)恢复电解前状况.
III.NO2、O2和熔融KNO3可制作燃料电池,其原理如图2
(1)请写出负极的电极方程式:______.
(2)相同条件下,放电过程中消耗的NO2和O2的体积比为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com