
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 煤焦油、石油、花生油都属于烃 | |
| C. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| D. |  + +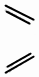 $\stackrel{△}{→}$ $\stackrel{△}{→}$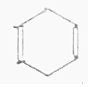 反应属于加成反应 反应属于加成反应 |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:推断题
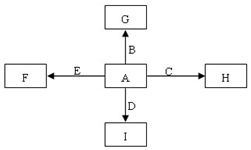 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接;
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接; ,它的空间构型是直线型;
,它的空间构型是直线型;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Co2O3+6HCl=2CoCl2+Cl2↑+3H2O中,氧化剂和还原剂物质的量之比为1:6 | |
| B. | 5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O中,氧化产物和还原产物物质的量之比为5:1 | |
| C. | 3S8+24KOH=8K2SO3+4K2S4+12H2O中,被氧化和被还原的S8物质的量之比为2:1 | |
| D. | 3(NH4)2SO4=3SO2+N2+6H2O+4NH3中,反应中发生氧化反应和未发生氧化反应的氮元素物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
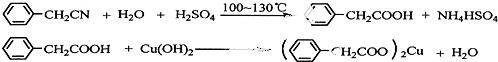
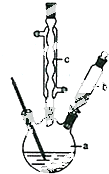
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
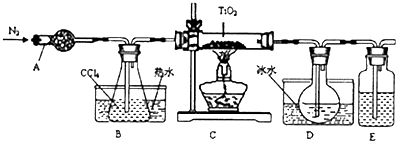
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com