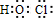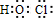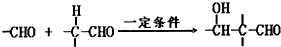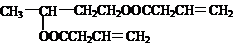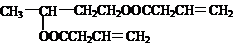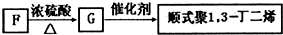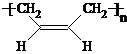(2012?河东区一模)室内甲醛污染已被列入对公众健康影响最大的环境因素之一,市面上有一种光催化涂料,能够起到降低室内甲醛含量的作用.某化学兴趣小组想要通过此涂料来进行甲醛的光催化氧化反应,并测定被氧化的甲醛的量.设计实验装置如下:

实验时先开启紫外灯,缓缓鼓入空气;一段时间后停止反应,关闭紫外灯,再继续通入一会儿空气,向B中加入足量BaCl
2溶液,得到白色沉淀5.91g.
(1)福尔马林是催化氧化甲醇制得的含甲醛37%的水溶液,因此含有二种有机杂质,它们是
甲醇
甲醇
,
甲酸
甲酸
,福尔马林的一个用途是
浸制生物标本
浸制生物标本
.
(2)上图装置A中,碱石灰的作用是
吸收空气中的CO2
吸收空气中的CO2
,恒温水浴的目的是
使混合气中甲醛含量稳定(写使甲醛挥发亦可)
使混合气中甲醛含量稳定(写使甲醛挥发亦可)
.
(3)硬质玻璃管中,甲醛在光催化氧化条件下的反应方程式:
;
(4)向B中加入足量BaCl
2溶液后至得到5.91g白色沉淀的一系列操作依次是:过滤、
洗涤
洗涤
、干燥、
称量
称量
;过滤时需用的玻璃仪器除烧杯、玻璃棒外还有
普通漏斗
普通漏斗
.
(5)计算被氧化的甲醛的物质的量为
0.03
0.03
mol
(6)反应结束后,继续遭入一会儿空气的目的是
将残留在装置中的、CO2排出,被NaOH吸收,减小误差
将残留在装置中的、CO2排出,被NaOH吸收,减小误差
.
(7)甲同学认为,反应过程中部分甲醛可能被氧化为甲酸.为验证其存在,甲同学取B中溶液,分别选用下表试剂进行检验.但乙同学认为试剂选择均不合理,他的理由是:
| 甲同学选择的试剂 |
乙同学认为不合理的理由 |
| 紫色石蕊试液 |
紫色石蕊试液B中溶液呈碱性(NaOH足量),无法证明是甲酸(酸性) 紫色石蕊试液B中溶液呈碱性(NaOH足量),无法证明是甲酸(酸性) |
| 新制氢氧化铜 |
B中可能溶有过量的甲醛,无法证明是甲酸中醛基 B中可能溶有过量的甲醛,无法证明是甲酸中醛基 |




 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案