
 金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:
金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:| 实验组别 | 1 | 2 | 3 | 4 |
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
| 反应时间/h | 3 | 3 | 3 | 3 |
| 容器体积/L | 2 | 2 | 2 | 2 |
分析 (1)TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H=+1493kJ•mol-1,△S=+61J•K-1•mol-1,C(s)+O2(g)═CO2(g)△H=-394.3kJ•mol-1,可以依据热化学方程式和盖斯定律计算得到:TiO2(s)+2Cl2(g)+C(s)$\stackrel{高温}{?}$TiCl4(g)+CO2(g)△H1;
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),等于生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积;
(3)用判据△H-T△S来判断反应能否发生;
(4)①催化剂是通过降低反应的活化能来加快化学反应速率的;
②计算生成氧气的反应速率=$\frac{△c}{△t}$,反应速率之比等于化学方程式计量数之比计算氮气的反应速率,2N2(g)+6H2O(1)═4NH3(g)+3O2(g)△H=+1530.4kJ•mol-1,反应是吸热反应,升温平衡正向进行分析.
解答 解:(1)依据热化学方程式:①TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H=+1493kJ•mol-1,△S=+61J•K-1•mol-1,②C(s)+O2(g)═CO2(g)△H=-394.3kJ•mol-1,可以依据热化学方程式和盖斯定律计算①+②得到:TiO2(s)+2Cl2(g)+C(s)$\stackrel{高温}{?}$TiCl4(g)+CO2(g)△H1=+1098.7KJ/mol,
故答案为:+1098.7;
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),反应Ⅰ:TiO2(s)+2Cl2(g)+C(s)$\stackrel{高温}{?}$TiCl4(g)+CO2(g),反应的Kp=$\frac{p(C{O}_{2})p(TiC{l}_{4})}{{p}^{2}(C{l}_{2})}$,
故答案为:$\frac{p(C{O}_{2})p(TiC{l}_{4})}{{p}^{2}(C{l}_{2})}$;
(3)TiO2(s)+2Cl2(g)?TiCl4(1)+O2(g)△H=+151kJ/mol该反应中,反应物有2mol气体,生成物只有1mol气体,△S<0,又△H>0,则△H-T△S>0,故反应不能自发进行,金红石加碳氯化能在较温和条件下成功制取TiCl4的原因是焓变减小,熵变增大,有利于反应正向进行,
故答案为:金红石加碳氯化能在较温和条件下成功制取TiCl4的原因;
(4)①催化剂是通过降低反应的活化能来加快化学反应速率的,使用催化剂后,活化能降低,图象需要符合:1.两条线的起点、终点分别相同.2.有催化剂曲线最高处能量要低.3.反应物的总能量要低于生成物的总能量,图象为: ,
,
故答案为: ;
;
②在303K时,在3h内氧气的反应速率=$\frac{\frac{3.6×1{0}^{-6}mol}{2L}}{3h}$=6×10-7mol/L•h,用氮气表示其平均反应速率v(N2)=$\frac{2}{3}$v(O2)=$\frac{2}{3}$×6×10-7mol/L•h=4×10-7mol/L•h,
组别4中反应正反应为吸热反应,升高温度平衡正向移动,则n(NH3)应大于6.0×10-6mol,则组别4中反应未达到平衡状态,
故答案为:4×10-7,否,反应正反应为吸热反应,升高温度平衡正向移动,则n(NH3)应大于6.0×10-6mol.
点评 本题考查了热化学方程式书写、平衡常数表达式、影响化学平衡和化学反应速率因素的分析判断,概念计算是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 碱性锌锰电池 | B. | 氢氧燃料电池 | C. | 酸性锌锰电池 | D. | 镍镉电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)5.7 | I2184.0 |
| ③ | (c)19.4 | HCl-84.0 | HBr-67.0 | HI-35.5 |
| ④ | H2O100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、e的化学式分别为Ne、Br2、SnH4 | |
| B. | 系列②物质均有氧化性,系列③物质对应水溶液均是强酸 | |
| C. | 系列④中各化合物的稳定性顺序为:H2O>H2S>(d)>H2Te | |
| D. | 上表内的物质(c)和H2O,由于氢键的影响,其熔沸点在同族中特别高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
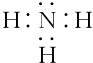 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com