
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.可以利用烧碱溶液除去混在MgO中的Al2O3 |
| B.用四氯化碳萃取碘水中的碘单质,上层显紫红色 |
| C.将Fe(OH)3沉淀溶于沸水可制得Fe(OH)3胶体 |
| D.测定Na2CO3溶液的pH值,操作时应将先pH试纸润湿 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.银镜反应实验后附有银的试管,可用稀H2SO4清洗 |
| B.在中学《硫酸铜晶体里结晶水含量测定》的实验,称量操作至少需要四次 |
| C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗 |
| D.在250ml 烧杯中,加入216g水和24g NaOH固体,配制10% NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验方法 | 实验方案 | 测量数据 |
| A. | 滴定法 | 将样品配成100 mL溶液,取10 mL,加入甲基橙,用标准盐酸滴定 | 消耗盐酸的体积 |
| B. | 量气法 | 将样品与盐酸反应,生成的气体全部被碱石灰吸收 | 碱石灰增重 |
| C. | 重量法 | 样品放入烧瓶中,置于电子天平上,加入足量盐酸 | 减轻的质量 |
| D. | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.偏大 | B.偏小 | C.不变 | D.大小不定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 实验序号 | 实验现象 | 化学方程式 |
| ① | 有气体产生,溶液变成浅红色 | |
| ② | 生成浅黄色沉淀 | Na2S+Cl2=2NaCl+S↓ |
| ③ | | 2Na+2H2O=2NaOH+H2↑ |
| ④ | 剧烈反应,迅速产生无色气体 | Mg+2HCl=MgCl2+H2↑ |
| ⑤ | 反应不十分剧烈,产生无色气体 | 2Al+6HCl=2AlCl3+3H2↑ |
| ⑥ | 开始时生成白色胶状沉淀,继而沉淀消失 | AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
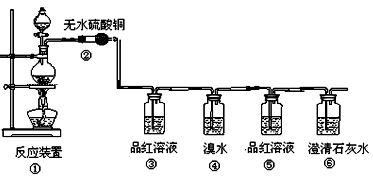
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com